SSE #147: MENSURAÇÃO E SUPLEMENTAÇÃO DA VITAMINA D: O QUÊ, QUANDO, POR QUE E COMO?
Publicado em
July 2015
Autor
Graeme L. Close
PONTOS-CHAVE:
- A vitamina D está associada com inúmeras ações biológicas relevantes aos atletas incluindo a regulação óssea, função imunológica, ciclo celular e homeostase musculoesquelética.
- A deficiência de vitamina D foi relacionada com muitas consequências adversas à saúde.
- Populações de atletas mostram concentrações consideravelmente baixas de vitamina D, particularmente durante os meses de inverno.
- A deficiência de vitamina D é reversível através da suplementação e exposição solar segura.
- Ensaios controlados randomizados bem delineados são necessários, no momento, para estabelecer até que ponto a vitamina D pode impactar a performance atlética.
REVISÃO DAS PESQUISAS SOBRE VITAMINA D
Histórico
A última década viu o renascimento das pesquisas sobre a vitamina D. Uma simples busca na PubMed para “vitamina D” forneceu mais de 3500 trabalhos em 2013, em comparação com pouco mais de 1000 trabalhos publicados em 1993. Isto é devido, em parte, ao ressurgimento de doenças ósseas preveníveis, como o raquitismo, estimulando o interesse nesta área. Em busca de um melhor entendimento sobre o metabolismo e função da vitamina D, surgiu uma multiplicidade de papéis biológicos para o hormônio esteróide. Desde a identificação do receptor de vitamina D em diversos tecidos, através dos quais a vitamina D exerce muitos de seus efeitos (Demay, 2006), e a criação de receptores de vitamina D em camundongos knockout (geneticamente modificados) (Li et al., 1997), houve um vasto avanço em nosso conhecimento de suas ações. Agora, já se entende que os aspectos da imunidade inata adquirida, saúde cardiovascular e processos biológicos na musculatura esquelética são regulados por ela.
Apesar do crescente entendimento sobre a importância da vitamina D, grandes estudos baseados em certas populações fornecem evidências que a deficiência de vitamina D é comum mundo afora, devido a um estilo de vida com pouca exposição solar e fontes alimentares pobres em vitamina D. Isto apresenta um problema específico para as populações de atletas, já que a deficiência pode passar despercebida, mas contribuir para a função imunológica e saúde óssea ruins, e possivelmente função muscular e capacidade regenerativa prejudicadas. Esta curta revisão irá explorar as considerações fundamentais quando se avalia e se interpreta as medidas do estado de vitamina D e protocolos de suplementação.
O que medir?
Há duas formas naturais da vitamina D, o ergocalciferol (vitamina D2) e o colecalciferol (vitamina D3). A vitamina D2 está disponível em pequenas quantidades em fontes vegetais e em alguns suplementos, enquanto a vitamina D3 é encontrada em fontes alimentares como peixes com alto teor de gordura e laticínios. No entanto, a maior fonte de vitamina D3, contribuindo com 90% da vitamina D, é obtida através da reação fotossintética na derme da pele, que ocorre quando a exposição à radiação suficiente de ultravioleta B (UVB) é alcançada. Esta exposição é dependente de roupas, etnicidade, estilo de vida e curiosamente o ápice solar, que é influenciado pela localização geográfica e hora do dia (Chen et al., 2007). Independentemente da rota de entrada, 99% da vitamina D é transportada pela ligação com a proteína ligadora de vitamina D (DBP) enquanto o restante é ligado à albumina (Chun et al., 2014). Ambas as vitaminas D2 e D3 sofrem hidroxilação no fígado, catalisadas pela 25-hidroxilase para formar a 25-hidroxi-vitamina D (25(OH)D) e hidroxilação posterior nos rins ou tecidos-alvo, expressando a enzima 1-α-hidroxilase para formar a forma biologicamente ativa da vitamina D, a 1-α-dihidroxivitamina2D3 (1-α,25(OH)D) (Figura 1).
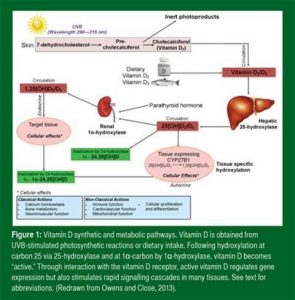
Figura 1: Via metabólica e de síntese da vitamina D. A vitamina D é obtida a partir das reações fotossintéticas estimuladas pela radiação UVB ou pela ingestão alimentar. Após a hidroxilação no carbono 25 via 25-hidroxilase e no carbono-1α pela 1α-hidroxilase, a vitamina D se torna “ativa”. Através da interação com o receptor de vitamina D, a vitamina D ativa regula a expressão de genes mas também estimula rápidas cascatas de sinalização em muitos tecidos. Veja texto para abreviações. (Redesenhado de Owens e Close, 2013).
Tradução da figura:
UVB (comprimento de onda – 290-315 nm)
Pele – 7-deidrocolesterol – Pré-colecalciferol – Fotoprodutos inertes – colecalciferol (D3)
Alimentação/Vitamina D2/Vitamina D3
Vitamina D3/D2
25-hidroxilase hepática
Circulação – 25(OH)D2/D3
Hormônio paratireoide
1α-hidroxilase renal
Circulação – 1,25(OH)D2/D3
Endócrina
Tecidos-alvo
Efeitos celulares
Inativação pela 24-hidroxilase para 1α-24,25(OH)D (em verde)
Expressão CYP27B1 no tecido
25(OH)D2/D3 – 1,25(OH)D2/D3
Efeitos celulares / Autócrina
Hidroxilação específica no tecido
Efeitos celulares:
Ações clássicas:
Homeostase do cálcio
Metabolismo ósseo
Função neuromuscular
Ações Não-clássicas:
Função imunológica
Função cardiovascular
Função mitocondrial
Proliferação e diferenciação celular
Quando se avalia o estado de vitamina D, no entanto, é o produto do estágio da primeira hidroxilação, a 25(OH)D que é escolhida para mensuração. Isto traz a questão “por que é preferível medir a forma biologicamente inativa da vitamina D e não a forma ativa?” A resposta é que a 25-hidroxilase hepática é regulada apenas pela concentração de 25(OH)D e nem um outro estímulo como o hormônio da paratireoide (PTH), que estimula a produção renal da 1α,25(OH)D quando as concentrações de 25(OH)D estão baixas (Kumar & Thompson, 2011). Medir a 1α 25(OH)D pode, portanto, resultar numa classificação errônea do estado de vitamina D de um indivíduo, em última análise resultando em erro de diagnóstico. Além disso, a 1α,25(OH)D circula em concentrações aproximadamente 1000 vezes menores que a 25(OH)D (Broadus et al., 1980) e tem uma meia-vida de ~15 horas, enquanto a 25(OH)D tem uma meia-vida de ~15 dias (Jones, 2008).
Como medir?
Resumidamente, o sangue é normalmente coletado através de venipuntura, e mais recentemente, “gotas de sangue” de uma simples picada no dedo do indivíduo têm sido avaliadas. O plasma (da venipuntura) ou sangue (das gotas de sangue) são isolados e utilizados para a análise a ser empregada. Há então diversos métodos de avaliação da 25(OH)D para determinar o estado da vitamina D. As análises disponíveis comercialmente incluem:
- Cromatografia líquida de alta pressão com espectrômetro de massas (LC-MS/MS)
- Ensaio radioimunológico (RIA)
- Ensaio imunoenzimático (EIA)
- Ensaio de ligação proteica competitiva (CPBA)
- Teste da proteína ligadora por quimioluminescência automatizada (CLPBA)
- Ensaio imunológico quimioluminescente (CLIA)
Quando se escolher um método de análise, é essencial considerar a validade e confiabilidade da ferramenta de mensuração. Particularmente, trabalhos sugerem que há uma variabilidade considerável entre as análises. No entanto, é aceito que a LC-MS/MS é o método mais válido e confiável para a medição da 25(OH)D, enquanto a performance da CLIA é a pior (Snellman et al., 2010). O programa internacional de controle de qualidade das dosagens de vitamina D (DEQAS – External Quality Assessment Scheme) existe para garantir a confiabilidade analítica das análises de 25(OH)D. Este programa DEQAS pode testar de maneira independente a performance do método analítico que um laboratório implementa para medir a 25(OH)D e fornece a certificação de proficiência.
O Que os Números Nos Dizem?
Primeiramente, é importante notar que dependendo da localidade, as concentrações circulantes dos metabólitos da vitamina D podem ser expressos em diferentes unidades. As duas unidades de medida relatadas mais comumente são ng/ml e nmol/l, onde 1ng/ml = 2,496 nmol/l. A unidade do sistema internacional (SI) para a vitamina D é nmol/l e será utilizada aqui.
Após os testes laboratoriais para análise da vitamina D (por exemplo, LC-MS/MS), uma leitura quantitativa é produzida dando uma indicação da vitamina D circulante no indivíduo. A vitamina D2 (25(OH)D2) e a D3 (25(OH)D3) podem ambas ser analisadas e referidas juntas como o total da 25(OH)D plasmática. No momento, há uma disparidade em relação a qual concentração da 25(OH)D plasmática constitui deficiência, adequação e estado “ótimo”. O Instituto de Medicina dos Estados Unidos (US IOM) atualmente fornece diretrizes que devem ser aceitas até que revisadas (Tabela 1).
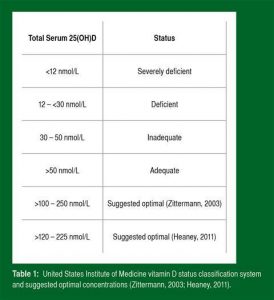
Tabela 1: Sistema de classificação do estado de vitamina D do Instituto de Medicina dos Estados Unidos e as concentrações ideais sugeridas (Zittermann, 2003; Heaney, 2011).
| 25(OH)D Plasmática Total | Classificação do Estado de Vitamina D |
| < 12 nmol/l | Deficiência Severa |
| 12 – 30 nmol/l | Deficiência |
| 30 – 50 nmol/l | Inadequado |
| >50 nmol/l | Adequado |
| >100 – 250 nmol/l | Sugestão de estado “ótimo” (Zittermann, 2003) |
| >120 – 225 nmol/l | Sugestão de estado “ótimo” (Heaney, 2011) |
Contudo, é digno de nota que inúmeros pesquisadores científicos não concordam com as diretrizes e sugerem que elas sejam muito conservadoras e ultrapassadas. Da literatura disponível e nossos próprios resultados, é evidente que há uma maior variação interindividual nas concentrações basais da vitamina D, em participantes testados numa mesma época do ano. Como um exemplo, a Figura 2 demonstra resultados cumulativos de um ensaio conduzido em nosso laboratório durante os meses do inverno em uma variedade de disciplinas atléticas. Uma observação importante destes dados mostrados abaixo é que a grande maioria dos atletas testados apresentaram o estado de vitamina D considerado deficiente ou inadequado, como sugerido pelo IOM dos Estados Unidos.
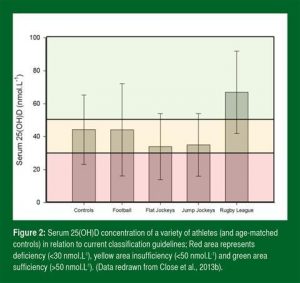
Figura 2: A concentração plasmática de 25(OH)D em diversos atletas (e controles com idade relacionada) em relação às diretrizes de classificação; área vermelha representa deficiência (50 nmol/l). (Dados adaptados de Close et al., 2013b).
Tradução da Figura:
25(OH)D Plasmática (nmol/l)
Controle / Futebol /Jóquei – Corridas Planas / Jóquei – Saltos / Liga de Rugby
Como Melhorar o Estado da Vitamina D?
Antes de discutirmos os mecanismos para melhorar o estado da vitamina D, há muitas questões que devem ser levadas em consideração. Assim como com as unidades de medida utilizadas para os metabólitos circulantes da vitamina D, há mais que uma unidade de medida para a suplementação com vitamina D. É extremamente importante distinguir entre as unidades internacionais (UI) e a µg. Assim, 100 UI = 2,5 µg de vitamina D2/D3. Certamente, confundir estas duas unidades de medida poderia resultar em doses extremamente altas ou muito baixas e ineficientes de vitamina D.
Uma consideração adicional antes da suplementação é se a vitamina D2 ou D3 é mais efetiva. De maneira bem simples, a vitamina D3 é aproximadamente 87% mais potente em aumentar e manter as concentrações plasmáticas de 25(OH)D e produzir 2 a 3 vezes mais estoques da vitamina D do que uma quantidade equimolar da vitamina D2 (Heaney, 2011).
Isto é um tanto intuitivo, já que a principal rota de obtenção da vitamina D é a via de síntese na derme, um processo que produz a vitamina D3.
Concentrações basais de vitamina D diferem grandemente entre os indivíduos (Figura 3) e isto pode levar a um impacto profundo relacionado à resposta da suplementação. A Figura 3 ilustra uma regressão linear simples adaptada de (Close et al., 2013) e Owens et al. (observação não publicada). O traçado descreve que os valores de referência da concentração de vitamina D são fortes indicadores da resposta à suplementação, exemplo, aqueles com a concentração plasmática basal de 25(OH)D baixa mostram a maior resposta à suplementação. Contudo, indivíduos com valores de referência da 25(OH)D similares podem não responder à suplementação de maneira comparável, já que a variação genética do gene da proteína ligadora de vitamina D parece influenciar a responsividade à suplementação (Nimitphong et al., 2013).
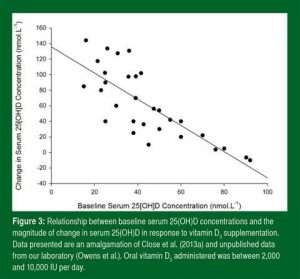
Figura 3: A relação entre as concentrações plasmáticas de referência de 25(OH)D e a magnitude das mudanças na 25(OH)D plasmática em resposta à suplementação com vitamina D3. Os dados apresentados são uma junção de Close et al. (2013a) e os dados não publicados do nosso laboratório (Owens et al.). A dose de vitamina D3 administrada oralmente foi entre 2.000 e 10.000 UI por dia.
Tradução da Figura:
Mudanças na Concentração Plasmática da 25(OH)D (nmol/l)
Concentração Plasmática de Referência da 25(OH)D
Em relação à dosagem, a 25(OH)D plasmática responde à suplementação de maneira dose-dependente para a vitamina D3 (Heaney et al., 2003). A questão mais apropriada, entretanto, é qual a concentração plasmática de 25(OH)D) a ser alcançada, já que esta (assim como a 25(OH)D basal) terá impacto na dose administrada. Este permanece um tópico de grande debate e a concentração plasmática universal para a otimização de todas as funções fisiológicas afetadas pela vitamina D está longe de ser estabelecida. No entanto, está se tornando mais aceito de maneira geral que a saúde é melhor com concentrações plasmáticas de 25(OH)D >75 nmol/l (Heaney, 2013). Para atingir as concentrações plasmáticas >75 nmol/l, nós demonstramos previamente que a suplementação oral com a vitamina D3 em uma dose de 5.000 UI/dia, por 8 semanas, pode efetivamente atingir este nível (Close et al., 2013a). Outros autores sugeriram que as concentrações plasmáticas estimadas necessárias para outros benefícios em relação à saúde estão acima de 100 nmol/l e que uma quantidade diária de 9.600 UI/dia seria necessária para manter tais concentrações plasmáticas (Garland et al., 2011). Como suporte, Michael Holick e colaboradores demonstraram que adultos em traje de piscina expostos à 1 Dose Eritermal mínima (MED), em uma cama de bronzeamento de radiação (UVB), aumentam os níveis sanguíneos de vitamina D para níveis equivalentes àqueles alcançados pela ingestão entre 10.000 e 25.000 UI de vitamina D (Holick, 2002).
Particularmente, estas doses de suplementação seriam consideradas ~8 vezes e ~16 vezes a ingestão diária recomendada (DRI), respectivamente, já que o IOM americano estabeleceu a DRI para a vitamina D de 600 UI/dia (para jovens adultos) e a ingestão máxima tolerável de 4000 UI/dia. Contudo, o IOM americano também estabeleceu que 10.000 UI/dia não possui “Efeitos Adversos Observáveis” (NOAEL). Contudo, é importante considerar que a síntese de vitamina D na derme através da exposição à radiação UVB é autorregulada, já que a pré-vitamina D é convertida em fotoprodutos inativos quando a síntese não é mais necessária (Holick et al., 1981). Tal mecanismo biológico não está disponível para a ingestão oral; portanto, se doses extremamente altas são ingeridas acima da NOAEL, elas podem causar toxicidade pela vitamina D, apesar de trabalhos sobre isto serem raros.
APLICAÇÕES PRÁTICAS PARA OS ATLETAS.
Levando em consideração a presente informação, há muitas considerações a se fazer quando se explora as aplicações práticas em relação ao nosso entendimento atual sobre o estado da vitamina D e sua suplementação.
- Concentrações de referência para a 25(OH) D total circulante de um atleta devem ser medidas considerando as diferenças interindividuais consistentemente observadas.
- As medidas devem ser realizadas utilizando a técnica mais válida disponível, preferencialmente a LC-MS/MS. O recente desenvolvimento da técnica da “gota de sangue” pode apresentar uma maneira mais prática de obter amostras de sangue em times esportivos.
- De acordo com a concentração de referência de um indivíduo, deve-se adotar uma estratégia de suplementação apropriada. Se o atleta apresentar concentrações plasmáticas < 75 nmol/l, então 5.000 UI/dia via oral é um protocolo efetivo para aumentar as concentrações para >75 nmol/l. Se o atleta apresenta deficiência de vitamina D (<30 nmol/l) e deficiência severa (< 12,5 nmol/l), uma dosagem de 10.000 UI/dia pode ser efetiva para aumentar as concentrações rapidamente em 4 semanas, o que pode ser mantido com 5.000 UI/dia.
- A amostragem sanguínea regular pode ser apropriada, especialmente durante os meses de inverno, para monitorar a eficácia do protocolo de suplementação.
- Sessões de exposição solar do corpo com Dose Eritermal mínima, de maneira segura, com duração de 30 minutos durante o verão podem ajudar a elevar a 25(OH)D total sem suplementação. Em altitudes mais ao norte, acima de 50°, isto pode ser mais difícil de atingir.
RESUMO
Resumindo, os dados sugerem que a deficiência de vitamina D é endêmica e sua frequência está aumentando, uma observação consistente em subgrupos de atletas. Isto pode acontecer principalmente devido a um estilo de vida com pouca exposição solar e fontes alimentares pobres em vitamina D. O custo da deficiência da vitamina D é a função biológica abaixo da ideal em muitos tecidos, e portanto, medidas são necessárias em atletas, particularmente durante os meses de inverno quando a exposição solar é baixa. Métodos bioquímicos apropriados para a avaliação da vitamina D devem ser adotados e implementada uma correta interpretação dos resultados. A DRI atual para a vitamina D (600 UI/dia) é improvável de ser eficaz para prevenir a deficiência na ausência de exposição solar. Se necessário (sob apresentação da 25(OH)D plasmática <75 nmol/l), é aconselhável suplementar oralmente com vitamina D3, com doses que reflitam a necessidade de mudança requisitada da 25(OH)D plasmática.
REFERÊNCIAS
Broadus, A.E., R.L. Horst, R. Lang, ET. Littledike, and H. Rasmussen (1980). The importance of circulating 1,25-dihydroxyvitamin D in the pathogenesis of hypercalciuria and renal-stone formation in primary hyperparathyroidism. N. Engl. J. Med. 302:421-426.
Chen, T.C., F. Chimeh, Z. Lu, J. Mathieu, K.S. Person, A. Zhang, N. Kohn, S. Martinello, R. Berkowitz, and M.F. Holick (2007). Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch. Biochem. Biophys. 460:213-217.
Chun, R.F., B.E. Peercy, E.S. Orwoll, C.M. Nielson, J.S. Adams, and M. Hewison (2014). Vitamin D and DBP: The free hormone hypothesis revisited. J. Steroid Biochem. Mol. Biol. 144:132-137.
Close, G.L., J. Leckey, M. Patterson, W. Bradley, D.J. Owens, W.D. Fraser, and J.P. Morton (2013a). The effects of vitamin D3 supplementation on serum total 25(OH) D concentration and physical performance: a randomised dose-response study. Br. J. Sports Med. 47:692-696.
Close, G.L., J. Russell, J.N. Cobley, D.J. Owens, G. Wilson, W. Gregson, W.D. Fraser, and J.P. Morton (2013b). Assessment of vitamin D concentration in non-supplemented professional athletes and healthy adults during the winter months in the UK: implications for skeletal muscle function. J. Sports Sci. 31:344-353.
Demay, M.B. (2006). Mechanism of vitamin D receptor action. Ann. N. Y. Acad. Sci. 1068:204-213.
Garland, C.F., C.B. French, L.L. Baggerly, and R.P. Heaney (2011) Vitamin D supplement doses and serum 25-hydroxyvitamin D in the range associated with cancer prevention. Anticancer Res. 31:607-611.
Heaney, R.P. (2011). Assessing vitamin D status. Curr. Opin. Clin. Nutr. Metab. Care 14:440-444.
Heaney, R.P. (2013). Health is better at serum 25(OH)D above 30ng/mL. J. Steroid Biochem. Mol. Biol. 136:224-228.
Heaney, R.P., K.M. Davies, T.C. Chen, M.F. Holick, and M.J. Barger-Lux (2003). Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am. J. Clin. Nutr. 77:204-210.
Heaney, R.P., P.R. Recker, J. Grote, R.L. Horst, and L.A. Armas (2011). Vitamin D3 is more potent than vitamin D2 in humans. J. Clin. Endocrinol. Metab. 96:E447-452.
Holick, M.F. (2002) Sunlight and vitamin D: both good for cardiovascular health. J. Gen. Intern. Med. 17:733-735.
Holick, M.F., J.A. MacLaughlin, and S.H. Doppelt (1981). Regulation of cutaneous previtamin D3 photosynthesis in man: skin pigment is not an essential regulator. Science 211:590-593.
Jones, G. (2008) Pharmacokinetics of vitamin D toxicity. Am. J. Clin. Nutr. 88:582S-586S.
Kumar, R., and J.R. Thompson (2011). The regulation of parathyroid hormone secretion and synthesis. J. Am. Soc. Nephrol. 22:216-224.
Li, Y.C., A.E. Pirro, M. Amling, G. Delling, R. Baron, R. Bronson, and M.B. Demay (1997). Targeted ablation of the vitamin D receptor: an animal model of vitamin D-dependent rickets type II with alopecia. Proc. Natl. Acad. Sci. USA 94:9831-9835.
Nimitphong, H., S. Saetung, S. Chanprasertyotin, L.O. Chailurkit, and B. Ongphiphadhanakul (2013). Changes in circulating 25-hydroxyvitamin D according to vitamin D binding protein genotypes after vitamin D3 or D2 supplementation. Nutr. J. 12:39.
Owens, D.J., and G.L. Close (2013). Vitamin D and athletic performance. Agro FOOD Industry Hi Tech, vol 24.
Snellman, G., H. Melhus, R. Gedeborg, L. Byberg, L. Berglund, L. Wernroth, and K. Michaelsson (2010), Determining vitamin D status: a comparison between commercially available assays. PLoS One 5:e11555.
Zittermann, A. (2003). Vitamin D in preventive medicine: are we ignoring the evidence? Br. J. Nutr. 89:552-572.






