SSE #174: O METABOLISMO DE FRUTOSE DE UMA PERSPECTIVA FUNCIONAL: IMPLICAÇÕES PARA OS ATLETAS
Publicado em
December 2017
Autor
Luc Tappy, MD
PONTOS-CHAVE:
- A frutose originalmente era um ingrediente natural sazonal, consumido principalmente no verão e outono em frutas e hortaliças. Na era industrial, ela se tornou um componente permanente da nossa alimentação, essencialmente um constituinte da adição de açúcares (sacarose, xarope de milho rico em frutose).
- A frutose não pode ser metabolizada diretamente pela maioria das células do nosso corpo. Ela precisa ser processada primeiro no intestino, fígado e rins, onde é convertida em glicose, lactato e ácidos graxos.
- A frutose alimentar em excesso, em conjunto com a ingestão excessiva de energia e baixo nível de atividade física, pode causar resistência hepática à insulina, hipertrigliceridemia e maior conteúdo de gordura hepática.
- Em atletas que se exercitam, a oxidação de carboidratos aumenta com a ingestão de glicose de maneira dose-dependente até que um platô seja atingido em aproximadamente 1g/min. A adição de frutose em bebidas com glicose pode aumentar, posteriormente, a oxidação de carboidratos.
- Durante o exercício, quantidades substanciais de frutose podem ser convertidas em lactato em órgãos esplâncnicos, quando disponível, e liberado na circulação sistêmica para ser oxidado nos músculos contráteis. Este “Ciclo de Cori reverso de frutose-lactato” fornece substrato energético adicional aos músculos durante o exercício.
- A conversão de frutose em glicose e lactato em órgãos esplâncnicos está associada com maior gasto energético esplâncnico, enquanto a eficiência energética muscular é minimamente alterada.
- Durante a recuperação após o exercício, a glicose e a frutose geram mutualmente o aumento da sua absorção intestinal e seus estoques de glicogênio no fígado.
INTRODUÇÃO
A frutose está naturalmente presente em frutas e hortaliças, como monossacarídeos (frutose “em sua forma livre”), ou como parte da sacarose, um dissacarídeo formado por uma molécula de glicose ligada a uma molécula de frutose. A glicose, a sacarose e a frutose ativam os receptores de sabor doce localizados na língua, que geram a ativação das vias dopaminérgicas de recompensa localizadas no sistema nervoso mesolímbico (Lenoir et al., 2007). A sensação desencadeada pelos alimentos doces, é portanto, sentida como prazerosa, e favorece o consumo de alimentos açucarados.
Nos primeiros hominídeos, o consumo de frutose das frutas, frutas vermelhas e mel pode ter sido substancial (revisado em Tappy & Rosset, 2017). No entanto, naquela época, a ingestão de frutose provavelmente flutuava com migrações geográficas e ritmicidade sazonal. Na era Neolítica, com o estabelecimento desses indivíduos como fazendeiros, os cereais se tornaram o principal componente alimentar e a fonte mais prevalente de carboidratos era o amido, um polímero da glicose. O açúcar permaneceu raro, um produto muito caro até o desenvolvimento das colônias europeias na Ásia e nas Américas. O seu consumo, no entanto, se tornou contínuo na era industrial. Em 1997, o consumo individual total de frutose teve uma média de 60g/dia nos EUA. Destes, praticamente 75% vinham de bebidas adoçadas com açúcar e alimentos industrializados (produtos à base de cereais, confeitaria e doces), aos quais o açúcar havia sido adicionado, e apenas 25% eram das frutas e hortaliças frescas (Marriott et al., 2009; 2010). Assim, a maior parte da frutose da nossa alimentação geralmente vem do açúcar refinado (sacarose) e na América do Norte, do xarope de milho rico em frutose (HFCS), que é uma mistura industrial de glicose e frutose em suas formas livres, com 42-55% de teor de frutose. No entanto, o consumo total de açúcares nos EUA, incluindo a frutose, diminuiu em ~25% nos nove anos do período entre 1999/2000 e 2008/2009 (Welsh et al., 2011).
METABOLISMO DE FRUTOSE NO FÍGADO
A glicose é o substrato preferido das células eucariotas, e pode ser utilizada como fonte de energia por todas as células do organismo humano. Devido à necessidade de manter a energia entre as refeições, e o fato de que a gordura é mais compacta e mais leve que o carboidrato como forma de estoque de energia, a maioria das células humanas (com exceção do cérebro) evoluiu para contar com a glicose como fonte de energia, no período entre as refeições, e com os ácidos graxos como forma energética alternativa.
Em contrapartida, a frutose não pode ser metabolizada diretamente na maioria das células do nosso organismo. Ao invés disso, ela sofre um primeiro passo de processamento no fígado através da via conhecida como “frutólise”. Esta via envolve enzimas específicas metabolizantes da frutose: 1)a frutoquinase, que catalisa a síntese da frutose-1-fosfato (F-1-P); 2) a aldolase B, que catalisa a sua degradação em gliceraldeído e fosfato de dihidroxiacetona (DHAP); e 3) a trioquinase, que converte o gliceraldeído em gliceraldeído-3-fosfato (GAP) (Van den Berghe, 1994). Os produtos finais da frutólise, o GAP e o DHAP também são intermediários da glicólise, e portanto, os passos metabólicos posteriores são compartilhados com o metabolismo de glicose.
Quando a glicose é utilizada como substrato de energia no fígado, ou em qualquer outro tipo de célula do organismo, a glicólise é rigorosamente regulada para corresponder à demanda energética celular. Esta demanda é atingida pela inibição da fosfofrutoquinase (a enzima que converte frutose-6-fosfato em frutose 1,6-bisfosfato na via glicolítica), pelos níveis intracelulares de ATP e citrato. Por outro lado, quando a frutose é metabolizada nos hepatócitos, não há feedback negativo nas enzimas da frutólise, e todas as moléculas de frutose são completamente convertidas em triose-fosfato, que são então posteriormente processadas em acetil-CoA, lactato, glicose, e eventualmente ácidos graxos e triglicérides (Mayes, 1976).
A proporção relativa de frutose metabolizada em cada um destes produtos finais tem sido geralmente avaliada em estudos com isótopos. Em indivíduos em repouso, 30-50% da frutose ingerida foi secretada para a circulação como glicose, e 10-25% foi estocada como glicogênio hepático nas 4-6 horas após a ingestão (Sun & Empie, 2012). Além disso, 25% foi liberada para a circulação como lactato (Jandrain et al., 1993). Finalmente, a menor porção (~1-10%) da frutose pode ser convertida em ácidos graxos e triglicérides (TG) na via metabólica conhecida como “lipogênese de novo” (Sun & Empie, 2012).
METABOLISMO DE FRUTOSE NAS CÉLULAS TUBULARES PROXIMAIS DOS RINS E NOS ENTERÓCITOS
Embora seja geralmente pressuposto, para simplificação, que a frutose é metabolizada no fígado, já se sabe há muito tempo que as células tubulares proximais renais também expressam enzimas da frutólise. A importância funcional e possível disfunção patológica do metabolismo renal da frutose ainda permanecem bastante inexploradas. As concentrações circulantes da frutose normalmente não excedem 0,6mmol/L após as refeições, mas podem aumentar até 1-3mmol/L com a infusão intravenosa de frutose. Nestas condições, os rins contribuem com 20% do total do metabolismo de frutose (Björkman & Felig, 1982; Björkman et al., 1989).
Além dos hepatócitos e células tubulares proximais dos rins, pequenos enterócitos do intestino também expressam o maquinário enzimático completo necessário para o metabolismo da frutose (Haidari et al., 2002; Rajas et al., 1999). Os enterócitos ainda contribuem com a gliconeogênese total, da produção endógena de frutose e glicose, assim como com a lipogênese de novo e com a secreção de partículas de lipoproteínas ricas em TG. No entanto, a função local destas vias nos enterócitos e a contribuição relativa do intestino no metabolismo total da frutose, permanecem especulativas. Uma hipótese é que o metabolismo intracelular da frutose pode ser instrumental na promoção da absorção intestinal de frutose. Ao contrário da glicose, que é principalmente absorvida através do co-transportador ativo de glicose dependente de sódio (SGLT1), a frutose entra no enterócito pela difusão facilitada mediada pelo GLUT-5 (Douard & Ferraris, 2013).
EFEITO DO CONSUMO DA FRUTOSE EM HUMANOS
Em indivíduos saudáveis, o consumo de frutose está associado com a maior produção endógena de glicose, maiores concentrações plasmáticas de lactato e triglicérides no jejum e pós-prandial, e maiores concentrações de lipídeos intrahepatocelular. Estas alterações metabólicas são consequências diretas do processamento da frutose nas células que expressam a frutoquinase na região esplâncnica (visceral), e então podem ser consideradas como adaptações normais de uma dieta rica em frutose. Quando este consumo de frutose está associado com ingestão energética alta e baixo nível de atividade física pode, no entanto, favorecer o desenvolvimento de diabetes e doenças cardiovasculares. Por sua vez, alguns poucos trabalhos também indicam que marcadores iniciais destas alterações podem ser corrigidos quando a atividade física apropriada é realizada (Egli et al., 2013; Wilburn et al., 2015).
METABOLISMO DA FRUTOSE DURANTE O EXERCÍCIO
O exercício está associado com necessidades energéticas maiores dos músculos contráteis. Esta energia pode ser obtida pela oxidação de carboidratos (glicose) ou de gorduras, ou pela glicólise anaeróbica isoladamente (em períodos relativamente mais curtos).
A oxidação de carboidratos durante o exercício é parcialmente dependente da ingestão exógena de carboidratos. A glicose ingerida durante o exercício é oxidada de maneira dose-dependente até que um platô de ~1,0g/min seja tingido. Foi proposto que este limite é devido à absorção exógena de glicose ser máxima nestas taxas de ingestão de glicose (Hawley et al., 1992).
Muitos estudos têm avaliado se bebidas com frutose podem ser benéficas durante a prática de atividade física. Identificadas como “(13C) frutose”, foram mostradas como sendo oxidadas durante o exercício (Jandrain et al., 1993); no entanto, a frutose pura não conferiu nenhuma vantagem em comparação à glicose. Na verdade, efeitos gastrointestinais adversos secundários pela absorção incompleta da frutose pura, puderam ser observados (Jeukendrup, 2010). A frutose, no entanto, pode ter efeito benéfico quando administrada junto com a glicose, pelo aumento na absorção intestinal total de hexoses. De fato, a frutose entra no enterócito através do processo facilitado pelo transportador de glicose GLUT-5, ao invés do SGLT1 utilizado para a absorção da glicose. Muitos estudos documentaram que foi obtida uma maior oxidação total máxima de carboidratos exógenos com a ingestão de misturas de frutose-glicose versus a glicose isoladamente (Jeukendrup, 2010). O aumento na oxidação total de carboidratos com a adição de frutose às bebidas de glicose em atletas se exercitando (Jeukendrup, 2010), pode parecer surpreendente, dada à ausência da frutoquinase na musculatura esquelética, e o fato de que a hexoquinase muscular tem afinidade muito menor pela frutose do que pela glicose. Parece, portanto, refletir a oxidação muscular de glicose e/ou lactato sintetizados a partir da frutose nos hepatócitos.
CONVERSÃO ESPLÊNCNICA DE FRUTOSE EM LACTATO E O CICLO DE CORI HEPÁTICO-MUSCULAR REVERSO DURANTE O EXERCÍCIO
Há evidências experimentais sólidas de que a conversão de frutose em lactato no tecido esplâncnico é uma via metabólica importante para a eliminação de frutose. Estudos com cateterização em cachorros documentaram que o fígado tem uma captação líquida de lactato em condições de jejum e após refeições com glicose, mas alterna para a produção/liberação de lactato após administração de frutose (Donmoyer et al., 2002). E posteriormente, foi pressuposto que até 25% dos carbonos da frutose podem ser dispostos através desta via em condições de repouso (Topping & Mayes, 1971).
Um estudo documentou as vias utilizadas para a eliminação de frutose em atletas alimentados com glicose isoladamente, ou glicose com “13C-frutose”, durante exercícios submáximos. Quando a glicose pura foi administrada oralmente em doses bolus repetitivas em bebidas, em uma taxa de 2,0g/min, a produção de glicose e utilização do corpo inteiro (correspondendo à soma da produção de glicose endógena com a glicose absorvida no intestino, menos a captação de glicose hepática), foi ~1,0g/min, e foi igual à oxidação de carboidratos do corpo inteiro. A produção de lactato e utilização foi aproximadamente 0,6g/min e refletiu, principalmente, o trânsito da glicose-lactato entre as fibras da musculatura esquelética (Brooks, 2000). Em contrapartida, quando os indivíduos ingeriram uma mistura de 0,8g/min de “13C-frutose” + 1,2g de glicose/min, ao invés da glicose pura, a produção de ambos, glicose e lactato, aumentou significativamente, e a oxidação total de carboidratos posteriormente aumentou em 30%. Aproximadamente metade deste aumento foi explicada pela oxidação do lactato. Isto contrasta com o conceito geral de que o lactato é produzido principalmente pela musculatura esquelética para ser utilizado pelo fígado para sintetizar glicose (Ciclo de Cori) (Reichard et al., 1963), e indica que durante o metabolismo da frutose o fígado, na verdade, produz lactato para ser utilizado como substrato energético pela musculatura contrátil.
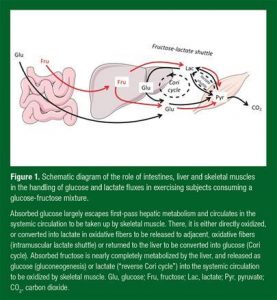
Figura 1. Diagrama do papel do intestino, fígado e musculatura esquelética no processamento dos fluxos de glicose e lactato em indivíduos praticando atividade física, consumindo uma mistura de glicose e frutose.
A glicose absorvida escapa em grande parte do primeiro passo do metabolismo hepático e transita na circulação sistêmica para ser captada pela musculatura esquelética. Lá, ela é diretamente oxidada, ou convertida em lactato nas fibras oxidativas para ser assim liberado às fibras oxidativas adjacentes, ou retorna ao fígado para ser convertido em glicose (Ciclo de Cori). A frutose absorvida é quase que completamente metabolizada pelo fígado, e liberada como glicose (gliconeogênese), ou lactato (“Ciclo de Cori reverso”), para a circulação sistêmica para serem oxidados pela musculatura esquelética. Glu, glicose; Fru, frutose; Lac, lactato; Pyr, piruvato; CO2, dióxido de carbono.
Tradução:
Trânsito da frutose-lactato (fructose-lactate shuttle)
Trânsito do lactato (lactate shuttle)
ENERGIA DA FRUTOSE E GLICOSE DURANTE O EXERCÍCIO
Substituir a glicose pela frutose como fonte dietética de energia durante o exercício tem algumas consequências na eficiência energética dos músculos (Tappy et al., 2013) (Figura 1). A glicose é captada pela ligação da musculatura esquelética e resulta na síntese total de 29,5 ATPs. Em geral, a oxidação de 1 molécula de glicose plasmática utiliza 6 moléculas de oxigênio (02) e 2 ATPs, e produz 6 moléculas de dióxido de carbono (CO2) e 29,5 ATPs, correspondendo ao ganho de 27,5 ATPs pela musculatura esquelética, por exemplo, 4,58 moléculas ATP/O2.
Em comparação, os fluxos de ATP, 02 e CO2 variam ligeiramente quando a frutose é metabolizada primeiro no fígado para ser secundariamente oxidada nos músculos (Tappy et al., 2013). Quando a frutose é convertida em glicose no fígado, ela consome 2 ATPs. Quando esta glicose recentemente sintetizada é posteriormente oxidada na musculatura esquelética, a via metabólica total utiliza 6 02 e 4 ATPs, e produz 6 CO2 e 29,5 ATPs para cada molécula de frutose, representando um ganho concreto de 25,5 ATPs, ou 4,25 ATP/oxigênio. Curiosamente, o rendimento de energia na musculatura esquelética é idêntico ao de glicose, mas há um gasto adicional de energia no fígado.
Quando a frutose é convertida em lactato, que é posteriormente oxidado na musculatura esquelética, o processo metabólico total utiliza 6 02 e 2 ATPs, e produz 6 CO2 e 29,5 ATPs, bem como a oxidação direta. No fígado, no entanto, a frutólise consome 2 ATPs e a conversão a piruvato produz 4 ATPs, resultando no ganho de 2 ATPs. Em contrapartida, na musculatura esquelética, 2 lactatos são transportados para dentro das células através de difusão facilitada e sua oxidação mitocondrial completa exige 6 02 e produz 25,5 ATPs, correspondendo a 4,25 ATP/oxigênio.
Em resumo, a eficiência energética da oxidação de frutose na musculatura é de alguma forma menor que a oxidação de amido ou glicose da alimentação. No entanto, a frutólise hepática em lactato pode fornecer suprimento substancial de energia para a musculatura em exercício, quando a taxa de glicólise é limitada.
EFEITOS DA FRUTOSE EXÓGENA DURANTE A RECUPERAÇÃO
Após o exercício, os atletas enfrentam um segundo desafio metabólico, ou seja, eles têm que restaurar seus estoques iniciais de energia ou glicogênio, nos músculos e no fígado. Esta é a principal questão para atletas envolvidos em atividades repetitivas extenuantes, como o ciclismo com duração de muitos dias, eventos de corridas, ou jogos em dias consecutivos, assim como treinamentos em geral. Nestes casos, a recuperação dos estoques de energia tem um papel fundamental na performance e adaptação aos treinos.
Foi muito bem documentado que a síntese de glicogênio, tanto no fígado quanto no músculo, pode ocorrer após a ingestão de frutose (Nilsson & Hultman, 1974). Alguns estudos até sugeriram que a síntese hepática pós-prandial de glicogênio foi maior após a ingestão de frutose, do que a ingestão de glicose (Decombaz et al., 2011). Há também evidência limitada de que uma dieta rica em frutose possa aumentar o conteúdo intramiocelular de lipídeos (Le et al., 2009).
Curiosamente, seja nas frutas ou no mel, no açúcar refinado da cana ou da beterraba, ou em xarope de milho rico em frutose, a frutose é sempre associada com quantidades aproximadamente equivalentes de glicose. Estas duas hexoses facilitam mutualmente os seu metabolismos em tecidos esplâncnicos. Certamente, a taxa máxima de absorção de frutose pura é limitada em muitos indivíduos, e parcialmente mal absorvidas, com ou sem sintomas gastrointestinais frequentemente observados após a ingestão de grande carga de frutose (Latulippe & Skoog, 2011). A co-ingestão da glicose com a frutose aumenta a absorção intestinal de frutose e previne a má absorção (Latulippe & Skoog, 2011). No fígado, a frutose-1-fosfato, intermediária da frutólise, interage com a proteína regulatória glicoquinase, e ainda ativa a glicoquinase e aumenta a síntese hepática de glicogênio. Curiosamente, as concentrações de F-1-P necessárias para exercer este efeito são muito baixas, e logo, isto pode ser observado com doses “catalisadoras” pequenas de frutose adicionadas às refeições com glicose (Moore et al., 2012). Estudos recentes têm demonstrado que a ingestão de sacarose após o exercício exaustivo melhora a ressíntese de glicogênio no fígado, em comparação com a glicose isoladamente (Fuchs et al., 2016; Gonzalez et al., 2017).
APLICAÇÕES PRÁTICAS
- A frutose pode constituir uma fonte energética importante na alimentação humana. É obviamente um nutriente dispensável, e nenhum efeito adverso de uma dieta carente de frutose foi relatado.
- A ingestão excessiva de frutose pode causar dislipidemia, armazenamento de gordura hepática e resistência hepática à insulina em indivíduos sedentários.
- Não há risco em ingerir quantidades razoáveis de frutose ao realizaratividade física, e os exercícios agem atenuando a possibilidade de efeitos prejudiciais da ingestão excessiva da frutose.
- Enquanto a glicose e os ácidos graxos permanecem sendo os substratos principais de energia para a musculatura esquelética contrátil, a frutose apresenta algumas possíveis vantagens para indivíduos envolvidos em exercícios físicos extenuantes, pela sustentação da produção da glicose hepática, e fornecendo energia extra como o lactato para a musculatura esquelética.
- Durante o exercício, a frutose pode ser convenientemente fornecida em alimentos líquidos ou sólidos, ricos em energia, e que são facilmente consumidos. Em comparação com a glicose, ela obtém uma resposta glicêmica mínima. A frutose é absorvida por transportadores intestinais diferentes dos transportadores utilizados na absorção da glicose, o que pode permitir que ela aumente a provisão energética para os músculos quando a utilização de glicose é estimulada ao máximo.
- No período de recuperação, a frutose administrada com a glicose pode ser conveniente, um método bem tolerado para aumentar a absorção total de carboidratos e a ingestão total de energia, para aumentar a captação hepática de energia e a síntese de glicogênio.
RESUMO
A frutose é uma hexose, naturalmente presente nas frutas, no mel, sacarose e xarope de milho rico em frutose. Ao contrário da glicose, a frutose não pode ser diretamente metabolizada pelas células do nosso corpo, e precisa ser primeiro convertida em lactato, glicose ou ácidos graxos. Este processamento dos carbonos de frutose é realizado pelos enterócitos, hepatócitos e células tubulares proximais dos rins, já que todas expressam enzimas específicas do metabolismo da frutose. Em indivíduos saudáveis, a ingestão excessiva de frutose está associada com o aumento da produção endógena de glicose, aumento das concentrações de triglicérides plasmáticos em jejum e pós-prandial, hiperlactatemia, e um aumento nas concentrações intrahepatocelulares de lipídeos. Quando associada com alta ingestão energética e baixo nível de atividade física, estas alterações metabólicas podem favorecer o desenvolvimento de diabetes e doenças cardiovasculares. Quando a frutose é ingerida durante o exercício, a produção esplâncnica de lactato e a oxidação de lactato na musculatura esquelética constitui uma via fisiológica para a utilização de energia da frutose. Durante a recuperação após o exercício, a co-ingestão de glicose e frutose pode aumentar a absorção total de carboidratos digeridos e pode aumentar a reposição de glicogênio.
REFERÊNCIAS
Björkman, O., and P. Felig (1982). Role of the kidney in the metabolism of fructose in 60-hour fasted humans. Diabetes 31:516-520.
Björkman, O., R. Gunnarsson, E. Hagström, P. Felig, and J. Wahren (1989). Splanchnic and renal exchange of infused fructose in insulin-deficient type 1 diabetic patients and healthy controls. J. Clin. Invest. 83:52-59.
Brooks, G.A. (2000). Intra- and extra-cellular lactate shuttles. Med. Sci. Sports Exerc. 32:790-799.
Decombaz, J., R. Jentjens, M. Ith, E. Scheurer, T. Buehler, A. Jeukendrup, and C. Boesch (2011). Fructose and galactose enhance postexercise human liver glycogen synthesis. Med. Sci. Sports Exerc. 43:1964-1971.
Donmoyer, C.M., D.B. Lacy, Y. Zhang, S.S. Chen, and O.P. McGuinness (2002). Impact of chronic fructose infusion on hepatic metabolism during TPN administration. Am. J. Physiol. 283:E1151-E1158.
Douard, V., and R.P. Ferraris (2013). The role of fructose transporters in diseases linked to excessive fructose intake. J. Physiol. 591:401-414.
Egli, L., V. Lecoultre, F. Theytaz, V. Campos, L. Hodson, P. Schneiter, B. Mittendorfer, B.W. Patterson, B.A. Fielding, P. Gerber, V. Giusti, K. Berneis, and L. Tappy (2013). Exercise prevents fructose-induced hypertriglyceridemia in healthy young subjects. Diabetes 62:2259-2265.
Fuchs, C.J., J.T. Gonzalez, M. Beelen, N.M. Cermak, F.E. Smith, P.E. Thelwall, R. Taylor, M.I. Trenell, E.J. Stevenson, and L.J. van Loon (2016). Sucrose ingestion after exhaustive exercise accelerates liver, but not muscle glycogen repletion compared with glucoe ingestion in trained athletes. J. Appl. Physiol. 120:1328-1334.
Gonzalez, J.T., C.J. Fuchs, J.A, Betts, and L.J. van Loon (2017). Glucose plus fructose ingestion for post-exercise recovery – greater than the sum of its parts? Nutrients 9:E344.
Haidari, M., N. Leung, F. Mahbub, K.D. Uffelman, R. Kohen-Avramoglu, G.F. Lewis, and K. Adeli (2002). Fasting and postprandial overproduction of intestinally derived lipoproteins in an animal model of insulin resistance. Evidence that chronic fructose feeding in the hamster is accompanied by enhanced intestinal de novo lipogenesis and ApoB48-containing lipoprotein overproduction. J. Biol. Chem. 277: 31646-31655.
Hawley, J.A., S.C. Dennis, and T.D. Noakes (1992). Oxidation of carbohydrate ingested during prolonged endurance exercise. Sports Med. 14:27-42.
Jandrain, B.J., N. Pallikarakis, S. Normand, F. Pirnay, M. Lacroix, F. Mosora, C. Pachiaudi, J.F. Gautier, A.J. Scheen, J.P. Riou, and P.J. Lefebvre (1993). Fructose utilization during exercise in men: rapid conversion of ingested fructose to circulating glucose. J. Appl. Physiol. 74:2146-2154.
Jeukendrup, A.E. (2010). Carbohydrate and exercise performance: the role of multiple transportable carbohydrates. Curr. Opin. Clin. Nutr. Metab. Care 13:452-457.
Latulippe, M.E., and S.M. Skoog (2011). Fructose malabsorption and intolerance: effects of fructose with and without simultaneous glucose ingestion. Crit. Rev. Food Sci. Nutr. 51:583-592.
Le, K.A., M. Ith, R. Kreis, D. Faeh, M. Bortolotti, C. Tran, C. Boesch, and L. Tappy (2009). Fructose overconsumption causes dyslipidemia and ectopic lipid deposition in healthy subjects with and without a family history of type 2 diabetes. Amer. J. Clin. Nutr. 89:1760-1765.
Lenoir, M., F. Serre, L. Cantin, and S.H. Ahmed (2007). Intense sweetness surpasses cocaine reward. PLoS One 2:e698.
Marriott, B.P., N. Cole, and E. Lee (2009). National estimates of dietary fructose intake increased from 1977 to 2004 in the United States. J. Nutr. 139:1228S-1235S.
Marriott, B.P., L. Olsho, L. Hadden, and P. Connor (2010). Intake of added sugars and selected nutrients in the United States, National Health and Nutrition Examination Survey (NHANES) 2003-2006. Crit. Rev. Food Sci. Nutr. 50:228-258.
Mayes, P.A. (1976). Control of hepatic triacylglycerol metabolism. Biochem. Soc. Trans. 4:575-580.
Moore, M.C., K.C. Coate, J.J. Winnick, Z. An, and A.D. Cherrington (2012). Regulation of hepatic glucose uptake and storage in vivo. Adv. Nutr. 3:286-294.
Nilsson, L.H., and E. Hultman (1974). Liver and muscle glycogen in man after glucose and fructose infusion. Scand. J. Clin. Lab. Invest. 33:5-10.
Rajas, F., N. Bruni, S. Montano, C. Zitoun, and G. Mithieux (1999). The glucose-6 phosphatase gene is expressed in human and rat small intestine: regulation of expression in fasted and diabetic rats. Gastroenterology 117:132-139.
Reichard, G.A.J., N.F. Moury, N.J. Hochella, A.L. Patterson, and S. Weinhouse (1963). Quantitative estimation of the Cori cycle in the human. J. Biol. Chem. 238:495-501.
Sun, S.Z., and M.W. Empie (2012). Fructose metabolism in humans – what isotopic tracer studies tell us. Nutr. Metab. 9:89.
Tappy, L., L. Egli, V. Lecoultre, and P. Schneider (2013). Effects of fructose-containing caloric sweeteners on resting energy expenditure and energy efficiency: a review of human trials. Nutr. Metab. 10:54.
Tappy, L., and R. Rosset (2017). Fructose metabolism from a functional perspective: implications for athletes. Sports Med. 47:S23-S32.
Topping, D.L., and P.A. Mayes (1971). The concentration of fructose, glucose and lactate in the splanchnic blood vessels of rats absorbing fructose. Nutr. Metab. 13:331-338.
Van den Berghe, G. (1994). Inborn errors of fructose metabolism. Ann. Rev. Nutr. 14:41-58.
Welsh, J.A., A.J. Sharma, L. Grellinger, and M.B. Vos (2011). Consumption of added sugars is decreasing in the United States. Am. J. Clin. Nutr. 94:26-34.
Wilburn, J.R., J. Bourquin, A. Wysong, and C.L. Melby (2015). Resistance exercise attenuates high-fructose, high-fat-induced postprandial lipemia. Nutr. Metab. Insights 8:29-35.






