SSE #191: VITAMINA D E O ATLETA – UMA SIMPLIFICAÇÃO DE UM COMPLEXO PROBLEMA BIOLÓGICO
Publicado em
May 2019
Autor
Graeme L. Close, Richard Allison, Daniel Owens
PONTOS CHAVE:
- O sistema endócrino da vitamina D é uma via biológica cada vez mais complexa em comparação ao que foi originalmente descrito na literatura das ciências do esporte.
- Muitos atletas têm baixas concentrações totais de vitamina D (25[OH]D).
- A suplementação com megadoses de vitamina D em bolus (dose concentrada), pode ser prejudicial para o metabolismo da vitamina D.
- A 25[OH]D e sua concentração total podem não ser atualmente o marcador mais adequado para indicar o estado da vitamina D.
- Concentrações muito baixas de vitamina D podem afetar negativamente a performance atlética tanto direta quanto indiretamente.
INTRODUÇÃO
A vitamina D é conhecida como a vitamina do sol, devido à produção da maior parte da vitamina D3 (colecalciferol) na pele acontecer pela exposição aos raios solares (ou mais especificamente, a exposição à radiação ultravioleta B). Essa radiação absorvida pela pele gera o precursor do colesterol, 7-dehidrocolesterol para formar a pré-vitamina D3 (Figura 1). A isomerização espontânea então altera a dupla ligação da pré-vitamina D3 que é termodinamicamente instável para produzir a vitamina D3, também conhecida como colecalciferol (Holick, 2004). A relevância da produção solar da Vitamina D fica clara quando consideramos países com baixa exposição solar por muitos meses do ano e que possui populações com as menores concentrações de vitamina D (Chen et al., 2007).
A vitamina D3 encontra-se na circulação principalmente ligada à proteína carreadora da vitamina D (DBP) e é convertida à 25-hidroxivitamina D (25[OH]D, também conhecida como calcifediol ou calcidiol) no fígado pelo controle das enzimas do citocromo P450 2R1 (CYP2R1) (Cheng et al., 2004; Shinkyo et al., 2004; Hamilton et al., 2010). A hidroxilação seguinte da 25[OH]D à forma ativa da vitamina D, denominada de 1,25 dihidroxivitamina D (1,25[OH]2D3, também conhecida como calcitriol) ocorre nos rins (Figura 1). Este metabólito bioativo é transportado no sangue aos tecidos-alvo expressando o receptor de vitamina D (VDR). É este metabólito que exerce os efeitos da vitamina D em diversos tecidos do corpo, ligando-se ao VDR e consequentemente regulando a transcrição de genes.
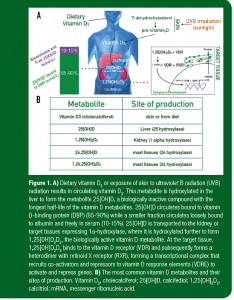
A
Vitamina D3 dietética – 7-dehidrocolesterol – pré-vitamina 3D/Pele – Radiação UVB (luz solar)
Vitamina D3 – 24,25[OH]D – 25[OH]D livre e ligada à DBP – 1,25[OH]2D3 – 1,24,25[OH]2D3
Biodisponível e livre 25[OH]D (nmol/L) 10-15%
25[OH]D ligada à DBP (nmol/L) 85-90%
Tecido-alvo
1,25[OH]2D3 +VDR
1,25[OH]2D3 VDR + RXR
1,25[OH]2D3 VDR + RXR – mRNA – Proteína
B
| Metabólito | Local de Produção |
| Vitamina D3 (colecalciferol) | Pele ou proveniente da dieta |
| 25[OH]D | Fígado (25-hidroxilase) |
| 1,25[OH]2D3 | Rins (1-alfa-hidroxilase) |
| 24,25[OH]D | Maioria dos tecidos (24-hidroxilase) |
| 1,24,25[OH]2D3 | Maioria dos tecidos (24-hidroxilase) |
Figura 1. A) A vitamina D3 dietética ou a exposição da pele à radiação ultravioleta B (UVB) resulta na vitamina D3 circulante. Este metabólito sofre hidroxilação no fígado para formar o metabólito 25[OH]D, um composto biologicamente inativo com a mais longa meia-vida dos metabólitos da vitamina D. A 25[OH]D circula ligada à proteína carreadora de vitamina D (DBP) (85-90%) enquanto uma fração menor circula com ligação fraca à albumina ou livremente no soro (10-15%). A 25[OH]D é transportada aos rins ou tecidos-alvo expressando a 1ª-hidroxilase, onde posteriormente sofre hidroxilação para formar a 1,25[OH]2D3, o metabólito biologicamente ativo da vitamina D. No tecido alvo, a 1,25[OH]2D3 se liga com o receptor de vitamina D (VDR) e consequentemente forma um heterodímero com o receptor do retinóide X (RXR), formando um complexo transcricional que recruta coativadores e inibidores aos elementos de resposta a vitamina D (VDRE) para ativar e inibir genes. B) O metabólito mais comum da vitamina D e seus locais de produção. Vitamina D3, colecalciferol; 25[OH]D, calcifediol; 1,25[OH]D2D3, calcitriol; mRNA (ácido ribonucleico mensageiro).
O estado da vitamina D é normalmente classificado utilizando-se as concentrações de 25[OH]D, em: severamente deficiente (< 12,5nmol/L), deficiente (12,5 – <30nmol/L), insuficiente (30-50nmol/L) ou suficiente (>50nmol/L) (The National Academies, 2011). No entanto, a classificação do que se constitui a deficiência de 25[OH]D é amplamente debatida (Owens et al., 2018). Por enquanto recomenda-se, portanto, sempre apresentar a concentração absoluta da vitamina D assim como essas definições arbitrárias.
COMO FUNCIONA A VITAMINA D?
As pesquisas nas últimas duas décadas estabeleceram que as muitas ações biológicas da 1,25[OH]2D3 são conduzidas através do controle das expressões gênicas, mediadas pela VDR (McDonnell et al., 1987; Haussler et al., 1998) (Figura 1). Interações diretas entre a 1,25[OH]2D3 e a VDR levam a interação do complexo 1,25[OH]2D3-VDR com o receptor do retinóide X (RXR). Este novo complexo formado pode então ligar-se aos elementos de resposta da vitamina D localizados acima dos genes-alvo da vitamina D, e através da seleção de coativadores e coinibidores, levam à ativação ou inibição dos genes, respectivamente (Sutton & MacDonald, 2003). Historicamente, assumiu-se que a expressão do gene-alvo da VDR era limitada à mucosa intestinal e aos ossos. No entanto, análises recentes indicam que a vitamina D afeta a expressão de 3% do genoma dos genes transcritos nas células-alvo incluindo aquelas do sistema imune, pele, pâncreas e musculatura esquelética (Holick, 2007).
QUAIS PAPÉIS DECLARADOS DA VITAMINA D SÃO BIOLOGICAMENTE RELEVANTES PARA A PERFORAMNCE ATLÉTICA?
A performance atlética é determinada por muitos fatores genéticos e ambientais (MacArthur & North, 2005) e a vitamina D tem sido proposta tanto como limitadora e também como fator que melhora a performance, nos estados de deficiência e abundância, respectivamente (Dueck et al., 1996; Cannell et al., 2009).
Saúde Óssea
Estudos recentes têm examinado a associação entre a vitamina D e as funções muscular e óssea em atletas, duas áreas que podem impactar a saúde e a performance atlética. O estado da vitamina D é um indicativo da absorção de cálcio e da mineralização óssea (Berry et al., 2002) e existe conhecimento considerável descrevendo a relação entre a deficiência da 25[OH]D e a saúde óssea (Collins et al., 1998; Holick, 2006; Cashman et al., 2008; Breen et al., 2011; Gutierrez et al., 2011; Sadat- Ali et al., 2011; Wöfl et al., 2013). Contudo, observações da deficiência de vitamina D falham universalmente em afirmar uma susceptibilidade proporcional à perda óssea, fraturas por osteoporose ou raquitismo (Hamson et al., 2003; Lowe et al., 2010), particularmente em atletas, uma população onde fraturas por estresse são frequentemente observadas (Johnson et al., 1994). Curiosamente, pesquisas recentes não mostram associação entre a concentração de 25[OH]D e indicadores de saúde óssea em uma população de atletas diversificada etnicamente, independentemente do tipo de exercício (levantamento de peso/sem peso) (Allison et al., 2016) apesar de outras demonstrarem diferenças raciais nas manifestações para a vitamina D e marcadores da saúde óssea (Cauley et al., 2005; Hannan et al., 2008). O que está claro é que as células ósseas são capazes de produzir a 1,25[OH]2D3 a partir do precursor 25[OH]D e que esta atividade é provavelmente a responsável pelos efeitos no esqueleto da 25[OH]D circulante (Anderson & Atkins, 2008). Para melhor entender a relação entre a vitamina D e a saúde óssea em atletas, nossos grupos recomeçaram a examinar os metabólitos alternativos da vitamina D que podem melhor refletir a atividade biológica da vitamina D (veja a sessão “A Medição da Vitamina D”)
Função Muscular e Reestruturação
Sabe-se que muitos atletas de elite são deficientes de vitamina D (Morton et al., 2012) e existe uma série de evidências exibindo o papel da vitamina D na musculatura esquelética. Estudos mostram resultados conflitantes entre o estado da vitamina D e a força muscular (Dhesi, 2004; El-Hajj Fuleihan, 2005; Annweiler et al., 2009; Ceglia et al., 2011). No entanto, Close et al. (2013) encontrou melhora nos tempos dos sprints de 10m e salto em altura vertical após suplementação com 5.000 UI de D3/dia. Sinha et al. (2013) também demonstrou que suplementar atletas severamente deficientes (< 15nmol/L) com 20.000 UI de D3 em dias alternados, elevou significativamente a recuperação da fosfocreatina em metade do tempo no músculo solear após atividade, indicativo de melhor função oxidativa mitocondrial. No entanto, outros estudos não mostraram melhora nas propriedades contráteis dos músculos em jovens ativos do sexo masculino com estado da vitamina D inadequado, após suplementação com 10.000 UI D3/dia ou placebo por 3 meses (Owens et al., 2014). Parece que em termos das funções musculares, problemas são apenas observados quando os atletas apresentam concentrações clinicamente baixas de vitamina D (<25nmol/L) (Stockton et al., 2011). Portanto, pode ser inteligente focar em corrigir as deficiências ao invés de tentar atingir concentrações suprafisiológicas.
Evidências recentes de estudos biológicos integrativos sugerem que manter a concentração sérica de 25[OH]D >50nmol/L pode ser benéfico para o processo de reparo da musculatura esquelética e potencialmente facilitar a reestruturação subsequente (Owens et al., 2015; 2017). A suplementação com 4.000 UI D3/dia em homens com concentração inadequada de vitamina D, tem sido mostrada levando à melhora da recuperação da força muscular após sessão de grande volume de contrações excêntricas dos membros inferiores (Owens et al., 2015). Além disso, os mioblastos esqueléticos retirados destes indivíduos e danificados in vitro mostraram melhor dinâmica da migração celular do músculo e melhor fusão/diferenciação dos miotubos junto com o aumento da hipertrofia dos miotubos. Estes dados são os primeiros a caracterizar um papel para a vitamina D na regeneração do músculo esquelético humano e sugerem que manter uma boa concentração da 25[OH]D sérica pode ser benéfico na melhora dos processos de reparo e potencialmente facilitar a hipertrofia decorrente (Owens et al., 2015).
Saúde Imunológica
Um importante fator que pode limitar a performance atlética é a saúde imunológica baixa. As infecções reduzem o tempo de jogo, disponibilidade para a triagem e interrompem os programas de treino. A vitamina D é conhecida há muito tempo por modular a saúde imunológica em uma variedade de populações. Um estudo de referência demonstrou que após ajuste na adiposidade, fatores do estilo de vida e socioeconômicos, cada 10nmol/L de aumento na 25[OH]D foi associado com uma redução de 7% no risco de infecções (Berry et al., 2011). Isto pode ter implicações importantes para os atletas que, quando vão além dos próprios limites ou tem restrição de nutrientes como carboidratos, podem comprometer a função imunológica (Gleeson & Walsh, 2012). Em um grupo de atletas, a vitamina D adicional para aumentar a 25[OH]D sérica foi suficiente para reduzir o risco de infecções durante um período de 16 semanas de treinos no inverno (He et al., 2013). Uma relação de causa e efeito também foi determinada para a vitamina D e a função imunológica, já que tanto as células da imunidade inata quanto as da imunidade adquirida expressam o receptor de vitamina D e as enzimas metabolizadoras da vitamina D e, sobretudo, são responsivas ao tratamento com vitamina D (Hewison, 2012).
A MEDIÇÃO DA VITAMINA D
Clinicamente, medir a concentração sérica da 25[OH]D fornece a melhor estimativa das concentrações de vitamina D (Holick, 1990; Iqbal, 1994) já que tanto a vitamina D3 (colecalciferol) quanto a 1,25[OH]2D3 têm meia-vida curta (24 horas e 4-6 horas, respectivamente) e as concentrações circulantes fornecem informações limitadas sobre o estado da vitamina D. Por outro lado, a 25[OH] D tem uma meia-vida sérica longa (3 semanas) e a etapa de hidroxilação 25 não é regulada, além de refletir na disponibilidade do substrato. Durante a deficiência da vitamina D, o hormônio da paratireoide aumenta e gera aumento na enzima renal 1-alfa-hidroxilase, e assim os níveis da 1,25[OH]2D3 aumentam. Apenas na deficiência severa, quando o substrato está escasso, é que a 1,25[OH]2D3 torna-se baixa. A deficiência da vitamina D tratada parcialmente também resulta em elevações importantes das concentrações da 1,25[OH]2D3.
Uma importância recente da proteína carreadora da vitamina D (DBP) e a biodisponibilidade de Vitamina D
Na maioria dos ensaios clínicos com atletas a concentração da 25[OH]D é medida como marcador do estado da concentração da vitamina D. No entanto, parece ter uma relação paradoxal entre a etnicidade e a concentração da vitamina D que foi bastante ignorada, já que atletas afrodescendentes geralmente têm as menores concentrações de vitamina D mas as maiores densidades minerais ósseas (DMO) e risco reduzido de fraturas (Cauley et al., 2005: Hannan et al., 2008). A proteína carreadora da vitamina D (DBP) fornece algumas percepções do porquê certos grupos étnicos terem relações distintas entre a DMO e a 25[OH]D (Powe et al., 2013). A DBP é a principal transportadora da vitamina D, ligando-se a 85-90% da 25[OH]D e 1,25[OH]2D3 circulante, a forma biologicamente ativa da vitamina D, e a 25[OH]D que permanece sem ligação com a DBP é considerada biodisponível. A vitamina D biodisponível é definida como a 25[OH]D que está livre ou ligada com a albumina. Aproximadamente 10-15% da 25[OH]D total está ligada com a albumina, ao contrário à 25[OH]D que está livre, que soma menos de 1% do total de vitamina D circulante (Bikle et al., 1986). Já que a afinidade da albumina com a 25[OH]D ou com a 1,25[OH]2D3 é mais fraca do que a ligação com a DBP, a fração com ligação fraca e a fração livre consistem na 25[OH]D biodisponível (Brown & Coyne, 2012).
A DBP tem muitas funções fisiológicas importantes incluindo o transporte dos metabólitos da vitamina D3, ligar-se/sequestrar a actina globular, e a ligação com os ácidos graxos. A genotipagem identificou dois polimorfismos de nucleotídeo único (SNP) comuns na região de codificação do gene DBP (rs4588 e rs7041) (Girgis et al., 2013). As combinações desses dois SNPs produzem as três principais formas polimórficas da DBP (Gc1F, Gc1S, e Gc2), que diferem substancialmente em suas afinidades de ligação pela 25[OH]D, concentração circulante, e a variação entre os grupos étnicos, que são por sua vez relacionados com a função da proteína carreadora da vitamina D. Portanto, a DBP pode ser responsável pelas diferenças raciais observadas nas manifestações da deficiência da vitamina D determinada pela 25[OH]D (Powe et al., 2013).
Estudos têm mostrado associações entre as concentrações da 25[OH]D sérica e diversos estados de doença e marcadores para a performance atlética (Cannell et al., 2009; Holick, 2004). No entanto, em uma população diversa em relação à etnia, não houve relação entre as concentrações séricas da 25[OH]D e marcadores de saúde óssea, independentemente do tipo do esporte (Allison et al., 2016). Também foi mostrado recentemente que a vitamina D biodisponível é um melhor indicador da densidade mineral óssea (Allison et al., 2018). Uma triagem sistemática para determinar as concentrações da 25[OH]D é cara, e já que ela demonstra uma relação pobre com a saúde óssea em população atlética etnicamente diversa, pode-se discutir que em comunidades atléticas, o teste da vitamina D deveria ser direcionado para os atletas sintomáticos (por exemplo, lesões musculoesqueléticas). Isto traz à tona a questão da validade do teste comumente utilizado em laboratórios para as concentrações da 25[OH]D na avaliação da deficiência da vitamina D e pode fornecer insights como o porquê de não existir um consenso aceito universalmente para as concentrações da vitamina D. Para os pesquisadores, a inclusão da genotipagem da DBP e medição da 25[OH]D livre seria benéfico para futuros ensaios que esperam analisar a relação da 25[OH]D com parâmetros da performance atlética e saúde do atleta. De uma perspectiva aplicada, talvez também seja o momento de desenvolver testes para medir a vitamina D biodisponível e, até que isto esteja disponível, triagens indiscriminadas de atletas deveriam ser questionadas. Em termos das concentrações da vitamina D biodisponível, dado que aproximadamente 10% da vitamina D total é biodisponível, pode-se discutir que 5nmol/L seja talvez uma recomendação adequada (baseando-se na concentração desejável de 50nmol/L para a vitamina D total) apesar dos dados que apoiam esta hipótese serem limitados já que isto é um tópico recente de pesquisas.
SUPLEMENTAÇÃO COM VITAMINA D – VOCÊ PODE ESTAR CONSUMINDO UMA COISA BOA EM EXCESSO
Quanto mais evidências os pesquisadores produzem, mais complexa é a tarefa de corrigir as baixas concentrações de vitamina D. Muitas vezes foi sugerido que as concentrações de 25[OH]D muito acima das diretrizes do Instituto de Medicina dos Estados Unidos são necessárias para se obter uma “saúde ideal” (Zittermann, 2003; Heaney, 2013), mas com pouca evidência sólida para apoiar esta hipótese. Assim sendo, esta ideia tem sido seguida em ensaios que utilizam grandes doses da vitamina D para atingir concentrações altas de 25[OH]D (> 100nmol/L). Médicos praticantes interpretam com frequência estas informações em suas práticas, empregando suplementação com megadoses, antes destes protocolos terem sido totalmente analisados. Evidências recentes debatem a hipótese de que altas concentrações da 25[OH]D são necessárias e que os suplementos com megadoses sejam eficazes. Um trabalho do nosso laboratório em conjunto com uma seleção profissional de atletas de esportes coletivos examinou as respostas metabólicas do sistema endócrino da vitamina D após suplementação com grandes doses de vitamina D, que normalmente são administradas nos times de esportes de elite (Owens et al., 2017). Nossos resultados demonstraram que a administração de uma dose bolus contendo 70.000 UI de vitamina D3 por semana resultou em aumentos significativos do catabolismo da vitamina D. Além disso, isso aumenta o metabólito inativo da vitamina D que sobreviveu o declínio dos metabólitos ativos após a suspensão da suplementação, o que poderia ser potencialmente prejudicial e poderia explicar os achados negativos associados da suplementação com megadoses de vitamina D (Sanders et al., 2010). Um bolus menor de 35.000 UI por semana não atingiu mudanças tão drásticas no catabolismo neste mesmo ensaio. Acreditamos que uma dose diária moderada da vitamina D3 pode, portanto, ser mais apropriada se há a necessidade de se suplementar com a vitamina D.
Além disso, como temos discutido no presente artigo, a 25[OH]D pode nem mesmo ser o melhor marcador para se estudar as respostas da suplementação, já que pode ser a fração livre da 25[OH]D que melhor se correlacione com a atividade biológica. Muito importante, esta fração difere entre as raças , portanto, é essencial para os novos estudos incluírem medidas da vitamina D biodisponível/livre para elaborar as estratégias de suplementação mais eficazes para a vitamina D. A preocupação é que por agora, podemos estar fazendo diagnósticos incorretos da deficiência baseando-se em uma análise inapropriada, e então prescrever uma dose de vitamina D ainda não testada, pode ser potencialmente prejudicial.
APLICAÇÕES PRÁTICAS
- Os passos recomendados para testar e identificar onde a suplementação com vitamina D pode ser necessária podem ser observados no quadro do fluxo da tomada de decisão observado na figura 2.
- Baseado em evidências atuais, suplementar diariamente ao contrário de semanalmente, com vitamina D3 na faixa de 2.000-4.000 UI/dia parece não oferecer efeitos prejudiciais e está dentro dos limites superiores de segurança europeu e americano ( The National Academies, 2011; European Food Safety Authority, 2012).
- A vitamina D3 deveria ser utilizada sob a forma D2, já que a última possui menor potência e sua importância biológica em humanos é debatida (Heaney et al., 2011). Esta estratégia da suplementação com D3 poderia ser utilizada em climas onde existe pouca exposição solar durante os meses de inverno (Outubro-Março) ou onde o clima, diferenças socioeconômicas e de estilo de vida impedem a exposição solar, como no Oriente Médio, onde a deficiência de vitamina D é prevalente (Hamilton et al., 2010).
- Quando possível, procurar exposição solar sensata (entre 10 da manhã e 3 da tarde, por 15 minutos, 6 dias na semana, 30-60ºN, com exposição corporal de 30%, por exemplo vestindo camiseta e shorts) durante os meses de verão para manter as concentrações de vitamina D adequadas sem a necessidade de suplementação, mesmo nos climas como o do norte da Inglaterra (Rhodes, 2012).
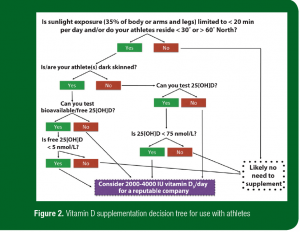
Figura 2. Quadro do fluxo de tomada de decisão para a suplementação com vitamina D, para utilização com atletas.
Tradução:
A exposição solar (35% do corpo ou pernas e braços) é limitada até <20 minutos por dia e/ou o atleta reside à <30º ou >60º Norte?
Sim / Não
Seu(s) atleta(s) tem(têm) pele morena?
Sim: Você pode testar a 25[OH]D biodisponível ou livre?
Sim: a 25[OH]D livre é < 5nmol/L? Sim/Não
Não: Você pode testar a 25[OH]D?
Sim: A 25[OH]D é <75nmol/L?
Provavelmente não existe necessidade de suplementação.
Considere 2000-4000UI de vitamina D3/dia de empresa idônea.
RESUMO
Na última década testemunhamos um interesse considerável na vitamina D em populações de atletas, com a suplementação de vitamina D tendo se tornado rotina atualmente em muitos esportes coletivos e em atletas individualmente. Este interesse originou-se de diversos estudos identificando “deficiências” em atletas. No entanto, dado as pesquisas recentes sugerirem que nosso método de avaliação de escolha pode não ser apropriado para identificar reais deficiências, somado com as evidências demonstrando potenciais efeitos prejudiciais da suplementação com megadoses, pode ser o momento para uma reflexão do período e reavaliação das estratégias atuais. O metabolismo da vitamina D é um campo em rápido desenvolvimento. Estamos chegando inevitavelmente mais perto de um cenário mais completo deste complexo sistema endócrino, mas muito mais ainda existe para ser aprendido. Está claro que as concentrações clinicamente baixas da vitamina D são prejudiciais para aspectos da saúde que influenciam a performance atlética, então é prudente tentar evitar estas deficiências com suplementação com baixas doses (~2.000 UI/dia no inverno) e focar menos em estratégias de suplementação para atingir as concentrações “ideais”. A pesquisa deveria se distanciar de simples relatos que ainda exista outro grupo de atletas apresentando baixas concentrações de 25(OH) D e, ao invés disso focar na vitamina D livre e num melhor entendimento de uma real associação entre a vitamina D e a função fisiológica. Um exame simples comercialmente disponível para a vitamina D livre precisa ser desenvolvido, mas, até que isto esteja de fato disponível, a triagem de rotina para a 25[OH]D em atletas pode ser uma custosa perda de tempo.
REFERÊNCIAS
Allison, R.J., A. Farooq, B. Hamilton, G.L. Close, and M.G. Wilson (2016). No association between vitamin D deficiency and markers of bone health in athletes. Med. Sci. Sports Exerc. 47:782- 788.
Allison, R. J., Farooq, A., Cherif, A., Hamilton, B., Close, G. L. and Wilson, M. G. (2018). Why don’t serum vitamin D concentrations associate with BMD by DXA? A case of being ‘bound’ to the wrong assay? Implications for vitamin D screening. Br J Sports Med 52: 522-526.
Anderson, P.H., and G.J. Atkins (2008). The skeleton as an intracrine organ for vitamin D metabolism. Mol. Aspects Med. 29:397-406.
Annweiler, C., O. Beauchet, B. Fantino, G. Berrut, M. Bonnefoy, F.R. Herrmann, and A.M. Schott (2009). Is there an association between serum 25-hydroxyvitamin D concentration and muscle strength among older women? Results from baseline assessment of the EPIDOS study. J. Nutr. Health Aging 13:90-95.
Berry, J.L., M. Davies, and A.P. Mee (2002). Vitamin D metabolism, rickets, and osteomalacia. Semin. Musculoskelet. Radiol. 6:173-182.
Berry, D.J., K. Hesketh, C. Power, and E. Hypponen (2011). Vitamin D status has a linear association with seasonal infections and lung function in British adults. Br. J. Nutr. 106:1433-40.
Bikle, D.D., E. Gee, B. Halloran, M.A. Kowalski, E. Ryzen, and J.G. Haddad (1986). Assessment of the free fraction of 25-hydroxyvitamin D in serum and its regulation by albumin and the vitamin D-binding protein. J. Clin. Endocrinol. Metab. 63:954-959.
Breen, M.E., E.M. Laing, D.B. Hall, D.B. Hausman, R.G. Taylor, C.M. Isales, K.H. Ding, N.K. Pollock, M.W. Hamrick, C.A. Baile, and R.D. Lewis (2011). 25-hydroxyvitamin D, insulin-like growth factor-I, and bone mineral accrual during growth. Am. J. Clin. Endocrinol. Metab. 96:E89-E98.
Brown, A.J., and D.W. Coyne (2012). Bioavailable vitamin D in chronic kidney disease. Kidney Int. 82:5-7.
Cannell, J.J., B.W. Hollis, M.B. Sorenson, T.N. Taft, and J.J. Anderson (2009). Athletic performance and vitamin D. Med. Sci. Sports Exerc. 41:1102-1110.
Cashman, K.D., T.R. Hill, A.A. Cotter, C.A. Boreham, W. Dubitzky, L. Murray, J. Strain, A. Flynn, P.J. Robson, J.M. Wallace, and M. Kiely (2008). Low vitamin D status adversely affects bone health parameters in adolescents. Am. J. Clin. Nutr. 87:1039 1044.
Cauley, J.A., L.Y. Lui, K.E Ensrud, J.M. Zmuda, K.L Stone, M.C. Hochberg, and S.R. Cummings (2005). Bone mineral density and the risk of incident nonspinal fractures in black and white women. J. Am. Med. Assoc. 293:2102-2108.
Ceglia, L., G.R. Chiu, S.S. Harris, and A.B. Araujo (2011). Serum 25-hydroxyvitamin D concentration and physical function in adult men. Clin. Endocrinol. 74: 370-376.
Chen, T., F. Chimeh, Z. Lu, J. Mathieu, K.S. Person, A. Zhang, N. Kohn, S. Martinello, R. Berkowitz, and M.F. Holick (2007). Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch. Biochem. Biophys. 460:213-217.
Cheng, J.B., M.A. Levine, N.H. Bell, D.J. Mangelsdorf, and D.W. Russell (2004) Genetic evidence that the human CYP2R1 enzyme is a key vitamin D 25-hydroxylase. Proc. Natl. Acad. Sci. USA 101: 7711-7715.
Collins, D., C. Jasani, I. Fogelman, and R. Swaminathan (1998). Vitamin D and bone mineral density. Osteoporos. Int. 8:110-114.
Close, G.L., J. Leckey, M, Patterson, W. Bradley, D.J. Owens, W.D. Fraser, and J.P. Morton (2013). The effects of vitamin D(3) supplementation on serum total 25[OH]D concentration and physical performance: a randomised dose-response study. Br. J. Sports Med. 47:692-696.
Dhesi, J.K. (2004). Vitamin D supplementation improves neuromuscular function in older people who fall. Age Ageing 33:589-595.
Dueck, C.A., K.S. Matt, M.M. Manore, and J.S. Skinner (1996). Treatment of athletic amenorrhea with a diet and training intervention program. Int. J. Sports Nutr. 6:24-40.
El-Hajj Fuleihan, G. (2005). Effect of vitamin D replacement on musculoskeletal parameters in school children: a randomized controlled trial. J. Clin. Endocrinol. Metab. 91:405-412.
European Food Safety Authority (2012). Scientific opinion on the tolerable upper intake level of vitamin D. EFSA J. 10:2813.
Girgis, C.M., R.J. Clifton-Bligh, M.W. Hamrick, M.F. Holick, and J.E. Gunton (2013). The roles of vitamin D in skeletal muscle: form, function, and metabolism. Endocrine Rev. 34:33–83.
Gleeson, M., and N.P. Walsh (2012). The BASES expert statement on exercise, immunity, and infection. J. Sports Sci. 30:321-324.
Gutierrez, O.M., W.R. Farwell, D. Kermah, and E.N. Taylor (2011). Racial differences in the relationship between vitamin D, bone mineral density, and parathyroid hormone in the National Health and Nutrition Examination Survey. Osteoporos, Int. 22:1745-1753.
Hamilton, B., J. Grantham, S. Racinais, and H. Chalabi (2010). Vitamin D deficiency is endemic in Middle Eastern sportsmen. Public Health Nutr. 13:1528-1534.
Hamson, C., L. Goh, P. Sheldon, and A. Samanta (2003). Comparative study of bone mineral density, calcium, and vitamin D status in the Gujarati and white populations of Leicester. Postgrad. Med. J. 79: 279-283.
Hannan, M.T., H.J. Litman, A.B. Araujo, C.E. McLennan, R.R. McLean, J.B. McKinlay, T.C. Chen, and M.F. Holick (2008). Serum 25-hydroxyvitamin D and bone mineral density in a racially and ethnically diverse group of men. J. Clin. Endocrinol. Metab. 93:40-46.
Haussler, M.R., G.K. Whitfield, C.A. Haussler, J.C. Hsieh, P.D. Thompson, S.H. Selznick, C.E. Dominguez, and P.W. Jurutka (1998). The nuclear vitamin D receptor: biological and molecular regulatory properties revealed. J. Bone Miner. Res. 13:325 349.
He, C.S., M. Handzlik, W.D. Fraser, A. Muhamad, H. Preston, A. Richardson, and M. Gleeson (2013). Influence of vitamin D status on respiratory infection incidence and immune function during 4 months of winter training in endurance sport athletes. Exerc. Immunol. Rev. 19:86-101.
Heaney, R.P., R.R. Recker, J. Grote, R.L. Horst, and L.A. Armas (2011). Vitamin D(3) is more potent than vitamin D(2) in humans. Am. J. Clin. Endocrinol. Metab. 96:E447 E452.
Heaney, R.P. (2013). Health is better at serum 25(OH)D above 30 ng/mL. J. Steroid. Biochem. Mol. Biol. 136:224-228.
Hewison, M. (2012). Vitamin D and immune function: an overview. Proc. Nutr. Soc. 71:50-61.
Holick, M.F. (1990). The use and interpretation of assays for Vitamin D and its metabolites. J. Nutr. 120 (Suppl. 11):1464-1469.
Holick, M.F. (2004).Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am. J. Clin. Nutr. 79:362-371.
Holick, M.F. (2006). Resurrection of vitamin D deficiency and rickets. J. Clin. Invest. 116:2062-2072.
Holick, M.F. (2007). Vitamin D deficiency. N. Engl. J. Med. 357:266-281.
Iqbal, S.J. (1994). Vitamin D metabolism and the clinical aspects of measuring metabolites. Ann. Clin. Biochem. 31:109-124.
Johnson, A.W., C.B. Weiss Jr., and D.L. Wheeler (1994). Stress fractures of the femoral shaft in athletes–more common than expected. A new clinical test. Am. J. Sports Med. 22:248-256.
Lowe, N.M., S.R. Mitra, P.C. Foster, I. Bhojani, and J.F. McCann (2010). Vitamin D status and markers of bone turnover in Caucasian and South Asian postmenopausal women living in the UK. Br. J. Nutr. 103:1706-1710.
MacArthur, D.G., and K.N. North (2005). Genes and human elite athletic performance. Human Gen. 116:331-339.
McDonnell, D.P., D.J. Mangelsdorf, J.W. Pike, M.R. Haussler, and B.W. O’Malley (1987). Molecular cloning of complementary DNA encoding the avian receptor for vitamin D. Science 235:1214-1217.
Morton, J.P., Z. Iqbal, B. Drust, D. Burgess, G.L. Close, and P.D. Brukner (2012). Seasonal variation in vitamin D status in professional soccer players of the English Premier League. Appl. Physiol. Nutr. Metab. 37:798-802.
Owens, D.J., D. Webber, S.G. Impey, J. Tang, T.F. Donovan, W.D. Fraser, J.P. Morton, and G.L. Close. (2014). Vitamin D supplementation does not improve human skeletal muscle contractile properties in insufficient young males. Eur. J. Appl. Physiol. 114:1309-1320.
Owens, D.J., A.P. Sharples, I. Polydorou, N. Alwan, T. Donovan, J. Tang, W.D. Fraser, R.G. Cooper, J.P. Morton, C. Stewart, and G.L. Close (2015). A systems-based investigation into vitamin D and skeletal muscle repair, regeneration, and hypertrophy. Am. J. Physiol. Endocrinol. Metab. 309:E1019-E1031.
Owens, D.J., J.C. Tang, W.J. Bradley, A.S. Sparks, W.D. Fraser, J.P. Morton, and G.L. Close (2017). Efficacy of high-dose vitamin D supplements for elite athletes. Med. Sci. Sports Exerc. 49:349-356.
Owens, D.J., R. Allison, and G.L. Close (2018). Vitamin D and the athlete: Current perspectives and new challenges. Sports Med. 48(Suppl 1):S3-S16.
Powe, C.E., M.K. Evans, J. Wenger, A.B. Zonderman, A.H. Berg, M. Nalls, H. Tamez, D. Zhang, I. Bhan, S.A. Karumanchi, N.R. Powe, and R. Thadhani (2013). Vitamin D binding protein and vitamin D status of black Americans and white Americans. N. Engl. J. Med. 369:1991-2000.
Rhodes, L.E. (2012) Maintaining vitamin D status in winter with ultraviolet B. Br. J. Dermatol. 166:238-239.
Sadat-Ali, M., A.H. Al Elq, H.A. Al-Turki, F.A. Al-Mulhim, and A.K. Al-Ali (2011). Influence of vitamin D levels on bone mineral density and osteoporosis. Br. J. Dermatol. 166:238-239.
Sanders, K.M., A.L. Stuart, E.J. Williamson, J.A. Simpson, M.A. Kotowicz, D. Young, and G.C. Nicholson (2010). Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. J. Am. Med. Assoc. 303:1815-1822.
Shinkyo, R., T. Sakaki, M. Kamakura, M. Ohta, and K. Inouye (2004). Metabolism of vitamin D by human microsomal CYP2R1. Biochem. Biophys. Res. Commun. 324 451 457.
Sinha, A., K.G. Hollingsworth, S. Ball, and T. Cheetham (2013). Improving the vitamin D status of vitamin D deficient adults is associated with improved mitochondrial oxidative function in skeletal muscle. Am. J. Clin. Endocrinol. Metab. 98:E509-E513.
Stockton, K.A., K. Mengersen, J.D. Paratz, D. Kandiah, and K.L. Bennell (2011). Effect of vitamin D supplementation on muscle strength: a systematic review and meta analysis. Osteoporos. Int. 23:859-871.
Sutton, A.L., and P.N. MacDonald (2003). Vitamin D: more than a “bone-a-fide” hormone. Mol. Endocrinol. 17: 777-791.
The National Academies, Dietary Reference Intakes for Calcium and Vitamin D (2011). Institute of Medicine. Vol. 1. 2011, Washington, DC: National Academic Press.
Wölfl, C., S. Englert, A.A. Moghaddam, G. Zimmermann, H. Schmidt-Gayk, B. Höner, A. Hogan, M. Lehnhardt, P.A. Grützner, and L. Kolios (2013). Time course of 25(OH)D3 vitamin D3 as well as PTH (parathyroid hormone) during fracture healing of patients with normal and low bone mineral density (BMD). BMC Musculoskel. Dis. 14:6.
Zittermann, A. (2003). Vitamin D in preventive medicine: are we ignoring the evidence? Br. J. Nutr. 89: 552-572.






