SSE #212:PROMOÇÃO DO ESTADO IDEAL DE ÁCIDOS GRAXOS ÔMEGA-3 EM ATLETAS
Publicado em
March 2021
Autor
Peter Ritz MS, RD, CSSD; Michelle Rockwell Ph.D., RD, CSSD
PONTOS-CHAVE:
- Tem sido demonstrado que os ácidos graxos ômega-3 (O3FA) geram um impacto na saúde e na performance de atletas de diversas maneiras, como, por exemplo, no gerenciamento de inflamações, na melhora da recuperação muscular, e na proteção da saúde e função cerebrais.
- As recomendações nutricionais para o O3FA são altamente variáveis, o que cria um desafio, particularmente na determinação das necessidades específicas de atletas. Um baixo estado de O3FA foi observado entre diversas populações atléticas.
- As fontes alimentares de O3FA contêm o ácido eicosapentaenoico (EPA), o ácido docosahexaenoico (DHA) e o ácido alfa-linolênico (ALA). Alimentos fontes de EPA e DHA são reduzidos na dieta, sendo os peixes gordurosos e os frutos do mar as fontes predominantes. Fontes alimentares de ALA são mais comuns, mas acredita-se que a conversão endógena de ALA em EPA e DHA seja geralmente modesta na melhor das hipóteses, enfatizando o valor da inclusão de peixes e frutos do mar na dieta de um atleta.
- A suplementação com EPA e DHA pode ser necessária para os atletas atingirem um estado ideal de O3FA. Uma ingestão de 1-3 g de EPA + DHA diariamente, abrangendo tanto as fontes alimentares quanto os suplementos, é uma meta sensata que poderia fornecer benefícios aos atletas apresentando um baixo risco para efeitos colaterais indesejáveis. Na seleção de um suplemento de O3FA, a fonte, a forma do suplemento, e a dosagem de O3FA, assim como a variedade de fatores específicos ao atleta devem ser considerados.
- Mais pesquisas são necessárias para melhor compreender o papel do O3FA na saúde e performance dos atletas e para identificar recomendações de O3FA específicas para esta população.
INTRODUÇÃO
Os ácidos ômega-3 (O3FA) são um grupo de gorduras insaturadas caracterizado por uma dupla ligação no terceiro carbono da sua estrutura bioquímica. Apesar da existência de diversos O3FA diferentes, o ácido eicosapentaenoico (EPA), o ácido docosahexaenoico (DHA) e o ácido alfa-linolênico (ALA) são os mais importantes e os que recebem maior atenção de pesquisas em termos da fisiologia e metabolismo humanos. A maioria dos benefícios na saúde e na performance relacionados com o consumo de O3FA foram associados com o EPA e com o DHA. Enquanto há a possibilidade da conversão de ALA (encontrado principalmente em fontes alimentares de origem vegetal) em EPA e DHA no corpo, a taxa de conversão é modesta, na melhor das hipóteses (Arterburn et al., 2006; Metherel & Bazinet, 2019). Logo, o consumo direto de EPA e DHA (encontrado principalmente em fontes provenientes do mar) é a melhor estratégia na obtenção destes nutrientes.
Com base em análises nutricionais (Ritz et al., 2020; Wilson & Madrigal, 2016) e avaliação das concentrações sanguíneas de O3FA (Anzalone et al., 2019; Davinelli et al., 2019; Ritz et al., 2020), uma grande parcela de atletas parece ter um baixo estado de O3FA. Existem maneiras e oportunidades para melhorar o estado de O3FA dos atletas através de fontes alimentares e suplementos. Uma barreira para a suplementação no contexto esportivo foi contornada em 2019 quando os suplementos de O3FA foram reclassificados pela Associação Atlética Universitária Nacional dos Estados Unidos (National Collegiate Athletic Association, NCAA) e permitidos aos atletas que são alunos da 1ª Divisão dos departamentos atléticos. No entanto, a tomada de decisão relacionada a este nutriente para atletas é complicada pela falta de diretrizes específicas para esta população no que diz respeito ao O3FA, pelos inúmeros fatores implícitos às fontes alimentares e aos suplementos, devido às inconsistências na literatura e nas pesquisas em desenvolvimento. O objetivo deste artigo do Sports Science Exchange é discutir as questões práticas envolvidas na promoção de um estado ideal de O3FA em atletas.
ÁCIDOS GRAXOS ÔMEGA-3 NA SAÚDE E PERFORMANCE DE ATLETAS
Como um componente da membrana fosfolipídica celular, o O3FA pode influenciar a composição e função de muitos tecidos por todo o corpo, incluindo o tecido cardiovascular, cerebral, da musculatura esquelética e do sistema imunológico (Witard and Davis (2021) SSE#211; Gerling et al., 2019; Shahidi & Ambigaipalan, 2018). O O3FA também é conhecido por atenuar a inflamação (Heaton et al., 2017). Há relações entre o estado de O3FA e o risco para doenças cardiovasculares, diabetes tipo II, câncer, artrite e declínio cognitivo, apesar de nem todos os estudos mostrarem benefícios da suplementação em indivíduos com estas condições (Nichols et al., 2014; Shahidi & Ambigaipalan, 2018).
Também há evidências associando o estado de O3FA a benefícios na saúde e performance em atletas. Uma revisão sistemática recente identificou 32 estudos relacionados à suplementação com O3FA e diversos marcadores da fisiologia e performance em atletas (Lewis et al., 2020). Sobretudo, foi relatada uma associação positiva entre a suplementação com O3FA e o tempo de reação, a recuperação da musculatura esquelética, marcadores inflamatórios e a dinâmica cardiovascular (Lewis et al., 2020). A suplementação também mostrou influenciar a síntese de proteína muscular, especialmente em condições como imobilização e restrição energética, ou quando consumida com outros nutrientes (Black et al., 2018; McGlory et al., 2016). Finalmente, foi identificado e, continua a ser investigado, um papel do O3FA (especialmente o DHA) na prevenção e tratamento de lesão traumática cerebral/concussão (Barrett et al., 2014; Oliver et al., 2016).
Um mecanismo pelo qual o O3FA pode impactar na saúde e na performance está relacionado com o equilíbrio entre os ácidos graxos ômega-6 (O6FA) e os O3FA no corpo humano. Apesar de ambos serem nutrientes essenciais, uma alta razão entre O6FA:O3FA foi associada com maior inflamação, trombose e saúde metabólica desregulada (McGlory et al., 2019). Fontes de O6FA incluem os óleos vegetais como o de soja e de milho, muitos alimentos altamente processados (como exemplo, molhos para salada, margarinas, snacks), algumas oleaginosas e sementes, produtos derivados de leite e carnes provenientes de animais alimentados com fibras. As dietas modernas, particularmente na América do Norte, evoluíram de tal maneira que hoje contêm substancialmente mais O6FA do que O3FA. Uma proporção média entre O6FA:O3FA de ~15:1 foi relatada na dieta americana, enquanto uma proporção de 4:1, ou menor, é frequentemente recomendada (Simopoulos, 2002). Digno de nota, a razão entre o ácido araquidônico (AA):EPA foi sugerida como um indicador possivelmente mais relevante do equilíbrio entre O6FA e O3FA na dieta, já que o AA e o EPA competem metabolicamente para a produção de eicosanoides (Davinelli et al., 2020).
O leitor deve consultar um artigo complementar do Sports Science Exchange (SSE) por Witard e Davis (2021), Oliver et al., (2018), Philpott et al., (2019) e Mickleborough (2013), para leitura adicional sobre o papel do O3FA na saúde e na performance de atletas.
NECESSIDADES DIÁRIAS DE ÁCIDOS GRAXOS ÔMEGA-3: QUANTIDADE MÍNIMA, IDEAL E LIMITE
Curiosamente, nenhuma diretriz com a Ingestão Dietética Recomendada (RDA) ou os Valores Diários (VD) para o O3FA foram estabelecidas. No entanto, existem diversas recomendações nutricionais. A Academia de Nutrição e Dietética e a Associação de Nutricionistas do Canadá, por exemplo, recomendam o consumo de 0,5 g de EPA + DHA diariamente, enquanto a Autoridade Europeia para a Segurança Alimentar recomenda 0,25 g de EPA + DHA diariamente (European Food Safety Authority, 2012; Omega-3 Global Intake Recommendations by Country, 2014; Vannice & Rasmussen, 2014). A Associação Americana do Coração (American Heart Association) recomenda que indivíduos saudáveis atinjam as necessidades de O3FA ingerindo duas porções ≥ 3,5 oz. (~100g) de peixe semanalmente, mas que indivíduos com doenças coronarianas consumam 1 g de EPA + DHA diariamente, e que aqueles com o nível sérico de triglicérides elevado procurem ingerir de 2-4 g EPA + DHA todos os dias (Siscovick et al., 2017).
Como nota, nenhuma das recomendações acima é específica aos atletas e muitas são baseadas na possível relação entre o O3FA e doenças coronarianas. Os atletas provavelmente necessitam de maior quantidade de O3FA que a população em geral, com fatores como sexo, peso corporal, metabolismo energético, volume de treinos e a resposta inflamatória ao exercício, todos influenciando estas necessidades (Davinelli et al., 2019; Drobnic et al., 2017; Flock et al., 2013; Tepsic et al., 2009; Walker et al., 2019b). Além disso, o nível mínimo efetivo de O3FA para a saúde e performance pode diferir do nível ideal. Benefícios terapêuticos e ergogênicos foram normalmente relacionados com doses maiores, obtidas através da suplementação, já que é difícil atingir altos níveis apenas com a dieta.
As recomendações relacionadas à quantidade máxima apropriada de O3FA para o consumo diário também são variadas. A Academia Nacional Americana de Medicina e a Autoridade Europeia para a Segurança Alimentar não estabeleceram um nível máximo para a ingestão de O3FA (Global Organization for EPA & DHA, 2014). Como o O3FA é conhecido por ter um papel na trombose, foram relatadas preocupações sobre um risco maior de sangramentos com a suplementação com O3FA. No entanto, uma revisão sistemática recente não identificou risco de sangramento associado a cirurgias em indivíduos saudáveis consumindo suplementos de O3FA (Begtrup et al., 2017). Outras possíveis consequências da ingestão excessiva de O3FA incluem um nível elevado do colesterol LDL (lipoproteínas de baixa densidade) e diversos sintomas gastrointestinais (Bradberry & Hilleman, 2013). De maneira geral, a quantidade de até 5 g de EPA+DHA, diariamente, foi normalmente descrita como bem tolerada e não associada com complicações adversas (European Food Safety Authority, 2012).
ATLETAS CONSOMEM NÍVEIS IDEAIS DE O3FA?
As dietas dos atletas demonstraram conter níveis de O3FA subótimos. Com base em avaliações nutricionais (questionário direcionado de frequência alimentar) com mais de 1.500 atletas de nove programas da 1ª Divisão Atlética da NCAA, Ritz et al., (2020) observou que menos de 40% dos atletas atingiu a recomendação de consumo de peixes ou alimentos de origem marinha pelo menos duas vezes, semanalmente, e menos de 10% dos atletas atingiu a recomendação da Academia de Nutrição e Dietética de consumir > 0,5 g EPA + DHA diariamente. Wilson e Madrigal (2016) relataram resultados semelhantes em atletas universitários.
O estado de O3FA também pode ser determinado através da avaliação de biomarcadores sanguíneos. Em geral, os ácidos graxos do plasma e do soro não são normalmente utilizados para avaliar o estado de O3FA, já que as concentrações são influenciadas pelo consumo alimentar mais recente. O Índice de Ômega-3 (O3i) tem sido cada vez mais utilizado em pesquisas, contextos clínicos e práticos como um biomarcador do estado de O3FA a longo prazo. O O3i reflete o conteúdo de EPA + DHA das membranas das células vermelhas sanguíneas (RBC), expresso como uma porcentagem dos ácidos graxos totais nas RBC. Os benefícios deste biomarcador são que ele se corresponde à ingestão alimentar e ao conteúdo do tecido, necessita de quantidade mínima de sangue (exemplo, obtenção de amostra de sangue de uma picada na ponta do dedo), e apresenta baixa variabilidade biológica (Harris & Thomas, 2010). Um O3i ≥ 8% está associado com o menor risco para doenças cardiovasculares (Harris, 2007). Há também evidência apoiando uma associação entre o O3i e a função cognitiva em indivíduos não-atletas (Cook et al., 2019). Diversos estudos identificaram um O3i médio de 3-4% em atletas (Anzalone et al., 2019; Davinelli et al., 2019; Ritz et al., 2020; von Schacky et al., 2014; Wilson & Madrigal, 2016). Uma avaliação do O3i pode ser de grande valor na triagem do estado de O3FA subótimo, no desenvolvimento de protocolos de tratamentos individualizados e na avaliação das respostas ao tratamento.
FONTES ALIMENTARES DE ÁCIDOS GRAXOS ÔMEGA-3
EPA E DHA
Algas, fitoplânctons e outros micro-organismos marinhos são produtores naturais de EPA e DHA. Por sua vez, peixes e frutos do mar que consomem estes micro-organismos são as fontes alimentares mais ricas destes nutrientes. No entanto, há uma variação significativa no conteúdo de O3FA nestes alimentos (Tabela 1). Por exemplo, peixes gordurosos como o salmão, a sardinha e o atum-azul têm pelo menos 1 g de EPA + DHA por porção (3 oz. ou 85 g). Fontes populares como o camarão, a vieira e o atum enlatado, por outro lado, contêm uma quantidade bem menor (< 0,2 g EPA + DHA por porção de 3 oz/85 g). A Tabela 2 ilustra os tamanhos das porções de alimentos comuns que fornecem 0,5-1 g de EPA + DHA.
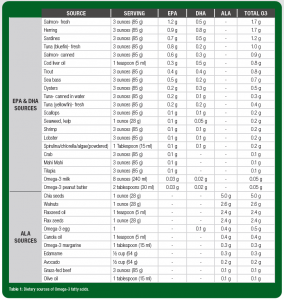
Tabela 1: Fontes alimentares de ácidos graxos ômega-3.
Tradução da Tabela:
| Fonte | Porção | EPA | DHA | ALA | O3 TOTAL | |
| Fontes de EPA e DHA
|
Salmão – fresco | 85g | 1,2 g | 0,5 g | – | 1,7 g |
| Arenque | 85g | 0,9 g | 0,8 g | – | 1,7 g | |
| Sardinha | 85g | 0,7 g | 0,5 g | – | 1,2 g | |
| Atum (azul) – fresco | 85g | 0,8 g | 0,2 g | – | 1,0 g | |
| Salmão – enlatado | 85g | 0,6 g | 0,3 g | – | 0,9 g | |
| Óleo de fígado de bacalhau | 1 col. chá (5ml) | 0,3 g | 0,5 g | – | 0,8 g | |
| Truta | 85g | 0,4 g | 0,4 g | – | 0,8 g | |
| Robalo | 85g | 0,5 g | 0,2 g | – | 0,7 g | |
| Ostras | 85g | 0,2 g | 0,3 g | – | 0,5 g | |
| Atum – enlatado em água | 85g | 0,2 g | 0,1 g | – | 0,3 g | |
| Atum (amarelo) – fresco | 85g | 0,2 g | 0,2 g | – | 0,4 g | |
| Vieira | 85g | 0,1 g | 0,1 g | – | 0,2 g | |
| Alga kelp (Laminariales) | 28g | 0,1 g | 0,05 g | – | 0,2 g | |
| Camarão | 85g | 0,1 g | 0,1 g | – | 0,2 g | |
| Lagosta | 85g | 0,1 g | 0,1 g | – | 0,2 g | |
| Spirulina/Chlorella/Alga marinha (em pó) | 1 col. sopa (15 ml) | 0,1 g | 0,1 g | – | 0,2 g | |
| Caranguejo | 85g | 0,1 g | – | – | 0,1 g | |
| Dourado-do-mar | 85g | 0,1 g | – | – | 0,1 g | |
| Tilápia | 85g | 0,1 g | – | – | 0,1 g | |
| Leite enriquecido com ômega-3 | 240ml | 0,03 g | 0,02 g | – | 0,05 g | |
| Pasta de amendoim enriquecida com ômega-3 | 2 col. sopa (30 ml) | 0,03 g | 0,02 g | – | 0,05 g | |
| Fontes de ALA | Semente de chia | 28g | – | – | 5,0 g | 5,0 g |
| Nozes | 28g | – | – | 2,6 g | 2,6 g | |
| Óleo de semente de linhaça | 1 col. chá (5ml) | – | – | 2,4 g | 2,4 g | |
| Semente de Linhaça | 28g | – | – | 2,4 g | 2,4 g | |
| Ovo enriquecido com ômega-3 | 1 | – | 0,1 g | 0,4 g | 0,5 g | |
| Óleo de canola | 1 col. chá (5ml) | – | – | 0,4 g | 0,4 g | |
| Margarina enriquecida com ômega-3 | 1 col. sopa (15 ml) | – | – | 0,3 g | 0,3 g | |
| Edamame | ½ xíc. (64g) | – | – | 0,3 g | 0,3 g | |
| Abacate | ½ xíc. (64g) | – | – | 0,2 g | 0,2 g | |
| Carne de vaca alimentada com capim | 85g | – | – | 0,1 g | 0,1 g | |
| Óleo de oliva | 1 col. sopa (15 ml) | – | – | 0,1 g | 0,1 g |

Tabela 2: Porções dos alimentos populares ricos EPA + DHA (0,5 – 1g)
Tradução da Figura:
Sardinha enlatada (3 oz., 85 g)
Filé de bagre ou palito de peixe (12 oz., 340 g)
Taco de peixe (feito com 10 oz. de bacalhau, 284 g)
Camarão grelhado ou frito (8 oz., 227 g)
Salmão grelhado (2 oz., 56 g)
Rolinho de lagosta (contendo 7 oz. de lagosta, 198 g)
Ostras (8 oz., 227 g)
Hambúrguer de salmão (5 oz., 142 g)
Massa com frutos do mar (com 9 oz. de camarão e vieira, 255 g)
Salada com algas marinhas (3 oz., 85 g)
Vitamina preparada com spirulina (2,5 colheres de sopa, 37 ml)
Sushi – roll de atum apimentado (4 pedaços)
Sanduíche com salada de atum (contendo 6 oz. de atum enlatado, 170 g)
ALA
Fontes alimentares de ALA incluem nozes, chia e linhaça, óleos vegetais e de sementes (Tabela 1). Carnes e ovos de animais alimentados com capim também contêm ALA como subproduto das dietas dos animais. Apesar destas fontes alimentares serem frequentemente recomendadas como um meio para melhorar o O3FA da dieta, elas não contêm EPA ou DHA (os nutrientes do O3FA mais associados com os benefícios para a saúde e performance), e a capacidade de conversão de ALA em EPA e DHA é relativamente baixa na fisiologia humana (Arterburn et al., 2006; Plourde & Cunnane, 2007), apesar de evidências recentes sugerirem que as taxas de conversão podem ser mais altas do que se havia estimado anteriormente (Metherel & Bazinet, 2019). Também é possível que indivíduos que não consomem peixes ou frutos do mar apresentem uma conversão maior de ALA, apesar de isto não ser conclusivo na literatura. Os atletas que seguem uma dieta vegetariana, têm alergias a peixes e frutos do mar, ou preferem não consumir peixes ou frutos do mar podem se beneficiar do consumo de algas-marinhas, algas kelp, alimentos fortificados ou da suplementação com O3FA (obtida das algas).
SUPLEMENTAÇÃO COM ÔMEGA-3
A suplementação nutricional é uma outra abordagem para melhorar o estado de O3FA . Além da recomendação para a utilização de produtos testados em relação à pureza e questões de segurança, diversos fatores adicionais podem ser considerados.
TIPOS DE PRODUTOS
Os suplementos de O3FA vêm de diversas fontes (peixes, krill e algas sendo as mais comuns) e contêm diversas formas de lipídios (etil ésteres, triglicérides, fosfolipídios e ácidos graxos livres), sobre as quais os profissionais de saúde devem estar familiarizados quando avaliam os produtos (Tabela 3). O óleo de peixe bruto tem origem direta do tecido de peixes gordurosos e contém menos de 30% de O3FA. A maioria dos produtos disponíveis são não-concentrados, enquanto outros sofrem um processamento mais rigoroso e são conhecidos como produtos concentrados de O3FA. Os suplementos de óleo de peixe em sua maioria incluem o O3FA na forma etil éster, e às vezes, nas formas de triglicérides, fosfolipídios e ácidos graxos livres. Os suplementos de óleo de krill, que contêm o óleo extraído do krill da Antártica, têm se tornado cada vez mais populares devido às suas concentrações mais altas das formas de fosfolipídios e ácidos graxos livres. O óleo de krill também contém um antioxidante chamado astaxantina, que previne a oxidação do O3FA e está associado com a uma melhor estrutura e função dos olhos (Barros et al., 2014). O óleo de alga é uma alternativa de origem vegetal, na forma de triglicérides e pode particularmente atrair os atletas vegetarianos.
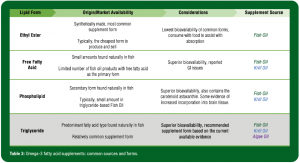
Tabela 3: Os suplementos de ácidos graxos ômega-3: formas e fontes comuns.
Tradução da figura:
| Forma Lipídica | Origem/Disponibilidade no mercado | Considerações | Fonte do Suplemento |
| Etil Ésteres | Feito sinteticamente, é a forma de suplemento mais comum
Normalmente, a forma mais barata para se produzir e vender |
Menor biodisponibilidade dentre as formas mais comuns, a consumo em conjunto com outros alimentos ajuda na absorção | Óleo de Peixe |
| Ácidos Graxos Livres | Pequenas quantidades encontradas naturalmente em peixes
Número reduzido de produtos de óleo de peixe com ácidos graxos livres como forma principal |
Alta biodisponibilidade, questões gastrointestinais relatadas | Óleo de Peixe
Óleo de Krill |
| Fosfolipídios | Segunda forma mais encontrada naturalmente em peixes
Normalmente, uma pequena quantidade de óleos de peixe têm base em triglicérides |
Alta biodisponibilidade, também contém o carotenoide astaxantina. Algumas evidências de maior incorporação no tecido cerebral | Óleo de Peixe
Óleo de Krill |
| Triglicérides | Tipo predominante de ácido graxo encontrado naturalmente em peixes
Forma de suplemento relativamente comum |
Alta biodisponibilidade, forma de suplemento recomendada com base nas evidências atuais disponíveis | Óleo de Peixe
Óleo de Krill Óleo de Alga |
BIODISPONIBILIDADE E INCORPORAÇÃO AOS TECIDOS
As diferentes formas de lipídios (etil ésteres, ácidos graxos livres, fosfolipídios e triglicérides) variam em termos de biodisponibilidade e incorporação aos tecidos específicos (Tabela 3). Diversos estudos sugerem que a biodisponibilidade do etil éster é inferior às outras formas e foi observado ser menos efetivo tanto em aumentar o O3i quanto em reduzir os níveis de triglicérides (Ghasemifard et al., 2014; Neubronner et al., 2011; Schuchardt et al., 2011). Na utilização de modelos animais, há alguma evidência de que a forma fosfolipídica pode ser preferencialmente incorporada pelos tecidos como os dos olhos e cérebro (Liu et al., 2014), mas há dados disponíveis insuficientes para fazer esta conclusão em humanos. Com base em evidências disponíveis, um suplemento baseado em triglicérides derivados do óleo de peixe ou do óleo de alga pode ser a melhor recomendação para muitos atletas neste momento, já que os suplementos na forma de ácidos graxos livres são altamente suscetíveis à oxidação e os produtos fosfolipídicos vêm comparativamente em menores dosagens, aumentando o custo por porção (Schuchardt & Hahn, 2013). Consumidores devem ser instruídos a tomar suplementos em conjunto com os alimentos, já que uma melhor absorção foi observada quando os suplementos foram ingeridos com refeições que continham gorduras (Lawson & Hughes, 1988).
INGREDIENTE ATIVO EM COMPARAÇÃO COM OS INGREDIENTES TOTAIS
Quando se avalia o custo-benefício dos produtos, é imperativo considerar o conteúdo de EPA + DHA do produto ao invés do conteúdo de “óleo de peixe” ou “O3FA”, e saber diferenciar entre um suplemento concentrado e um não-concentrado (Figura 1). Um produto concentrado de ômega-3 normalmente fornece uma alta dosagem de EPA + DHA por porção, oferecendo uma intervenção com maior custo-benefício.

Figura 1: Suplementos de ácidos graxos ômega-3. Procure pela dosagem de EPA + DHA ao invés da dose total de “óleo de peixe” ou “ômega-3”.
Informações sobre o Suplemento
Tamanho da Porção – 1 cápsula gelatinosa
Cada cápsula contém % Valores Diários
Calorias 10
Calorias de gorduras 10
Gorduras Totais 1 g 2%
Colesterol 10 mg 3%
Óleo de Peixe 1200 mg
Ácidos Graxos Ômega-3 (EPA = DHA) 250 mg
Outros Ácidos Graxos Ômega-3 50 mg
Rótulo A. Não Concentrado
Informações sobre o Suplemento
Tamanho da Porção – 1 cápsula gelatinosa
Cada cápsula contém % Valores Diários
Calorias 10
Calorias de gorduras 10
Gorduras Totais 1 g 2%
Colesterol 10 mg 3%
Ômega-3 concentrado do Óleo de Peixe 1200 mg
Total de Ácidos Graxos Ômega-3 1000 mg
EPA 650 mg
DHA 300 mg
Outros Ômega-3 50 mg
Rótulo B. Concentrado
O rótulo A é um exemplo de suplemento não-concentrado que fornece 1000 mg de óleo de peixe, mas apenas 250 mg de EPA + DHA
O rótulo B é um exemplo de um produto concentrado de Ômega-3, que tem uma quantidade mais alta de EPA + DHA por porção
DETERMINANDO A DOSAGEM ESPECÍFICA PARA O INDIVÍDUO
Há muitos fatores e abordagens para serem considerados na determinação da dosagem de um suplemento de O3FA, especificamente para atletas. Fatores como a dieta habitual, sexo, idade, peso corporal, carga de treino, se o indivíduo é fumante ou não, e outros, podem todos influenciar as recomendações. A Figura 2 esboça uma abordagem para a definição da dosagem com base na triagem e classificação de risco.
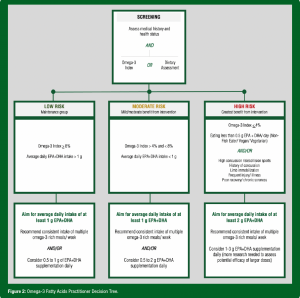
Figura 2: Fluxograma de Tomada de Decisão para Profissionais em relação aos Ácidos Graxos Ômega-3
TRIAGEM
Avaliar histórico médico e estado de saúde
E
Índice de Ômega-3 OU Avaliação Nutricional
RISCO BAIXO
Grupo de Manutenção
Índice de Ômega-3 ≥ 8%
Ingestão Média Diária de EPA + DHA > 1g
Meta de ingestão média diária de pelo menos 1 g de EPA + DHA
Recomende ingestão consistente de diversas refeições ricas em ômega-3/semana
E/OU
Considere 0,5 a 1 g de EPA + DHA de suplementação diária
RISCO MODERADO
Benefício leve/moderado com a intervenção
Índice de Ômega-3 > 4% e < 8%
Ingestão Média Diária de EPA + DHA < 1g
Meta de ingestão média diária de pelo menos 1 g de EPA + DHA
Recomende ingestão consistente de diversas refeições ricas em ômega-3/semana
E/OU
Considere 0,5 a 2 g de EPA + DHA de suplementação diária
RISCO ALTO
Melhor benefício com a intervenção
Índice de Ômega-3 ≤ 4%
Ingestão de menos de 0,5 g de EPA + DHA/dia (indivíduo que não come peixe/ Vegano / Vegetariano)
E/OU
Esportes com alto risco para concussão/colisões
Histórico de concussão
Imobilização de membro corporal
Lesões/doenças frequentes
Recuperação pobre/dores crônicas
Meta de ingestão média diária de pelo menos 2 g de EPA + DHA
Recomende ingestão consistente de diversas refeições ricas em ômega-3/semana
Considere 1-3 g de EPA + DHA de suplementação diária (mais pesquisas são necessárias para avaliar a eficácia em potencial obtida de doses maiores)
Uma abordagem para a suplementação é almejar um O3i de 8%, ou maior. Assumindo um O3i de referência perto da média americana de 4-5%, uma dose de 1 g/dia de EPA + DHA por 20 semanas (Flock et al., 2013), ou uma dose de 2 g/dia de EPA + DHA por 13 semanas (Walker et al., 2019a) foram observadas atingindo um O3i ≥ 8% em indivíduos adultos saudáveis. Enquanto mais pesquisas são necessárias para avaliar a dose-resposta específica aos atletas, um estudo preliminar observou que atletas olímpicos necessitaram de 1,5-2 g/dia de EPA + DHA, por pelo menos 16 semanas, para alcançar o referencial de O3i ≥ 8% (Drobnic et al., 2017). Uma vez que a meta para o O3i tenha sido atingida, uma dose menor de manutenção pode ser considerada.
Outra abordagem é selecionar uma dose específica para o objetivo da suplementação. Por exemplo, 1 g de EPA + 2g de DHA diariamente é uma recomendação comum para atletas quando a neuroproteção é o principal objetivo, devido à resposta do plasma, próxima da resposta máxima, observada com uma dose de 2g/dia de DHA (Arterburn et al., 2006; Oliver et al., 2018). Uma dosagem com base no peso corporal, utilizando até 40 mg/kg de peso como referência, também foi recomendada, baseando-se nas doses efetivas em pesquisas com animais (Flock et al., 2013; Mills et al., 2011). Acima de tudo, é importante notar que há uma variação significativa na dose-resposta individual (Walker et al., 2019a).
RESUMO E RECOMENDAÇÕES PRÁTICAS
- Apesar do O3FA ser conhecido por influenciar a saúde e performance dos atletas, há ainda muito a ser aprendido. Profissionais devem se comprometer em se manterem atualizados com as pesquisas e recomendações específicas aos atletas, e idealmente participarem de pesquisas aplicadas.
- Recomendações consistentes específicas aos atletas para o O3FA da dieta ou por suplementação não estão disponíveis. A ingestão mínima necessária para apoiar a saúde da população em geral pode diferir significativamente da ingestão ideal necessária para atletas que procuram melhorar a saúde e a performance.
- Como a maioria dos atletas demonstrou consumir uma quantidade de O3FA abaixo do ideal, há diversas oportunidades para melhorar o estado de O3FA dos atletas. Incorporar estratégias de planejamento com menus para promover o consumo frequente de alimentos ricos em EPA + DHA enquanto se negocia sobre as limitações no orçamento, preferências individuais e disponibilidade dos alimentos, é um papel importante para o profissional de nutrição.
- A obtenção de um estado ideal de O3FA poderá necessitar de suplementação. Suplementos disponíveis de O3FA variam em relação às fontes, formas e dosagens. Devido às evidências disponíveis até o momento, um suplemento concentrado de óleo de peixe ou óleo de alga com base na forma de triglicérides pode ser a melhor opção para muitos atletas.
- Já que muitos fatores influenciam o estado de O3FA e a resposta à suplementação, a dosagem individualizada da suplementação é recomendada sempre que possível. A Figura 2 destaca uma abordagem para recomendações individualizadas para a suplementação.
- Na situação em que um protocolo padronizado é mais prático do que recomendações individualizadas, uma dose diária de 1-3 g de EPA + DHA pode ser adequada. Alguns podem considerar uma dose mais alta para atletas com maior peso corporal, durante períodos com treinos intensos, ou quando a neuroproteção é o objetivo principal.
- Avaliar o estado de O3FA através da medida do índice de ômega-3 (O3i) nas RBC pode ser útil na triagem de atletas, na customização das recomendações de suplementação e na avaliação da dose-resposta. Se não for possível realizar a medição do O3i, os profissionais devem considerar a utilização de ferramentas validadas de avaliação nutricional para avaliar a ingestão habitual de O3FA.
Os pontos de vista expressos neste artigo são dos autores e não necessariamente refletem a posição ou política da PepsiCo, Inc.
REFERÊNCIAS
Anzalone, A., A. Carbuhn, L. Jones, A. Gallop, A. Smith, P. Johnson, L. Swearingen, C. Moore, E. Rimer, J. McBeth, W. Harris, K.M. Kirk, D. Gable, A. Askow, W. Jennings, and J.M. Oliver (2019). The Omega-3 Index in National Collegiate Athletic Association division I collegiate football athletes. J. Athl. Train. 54:7–11.
Arterburn, L.M., E.B. Hall, and H. Oken (2006). Distribution, interconversion, and dose response of n-3 fatty acids in humans. Am. J. Clin. Nutr. 83(6 Suppl):1467S-1476S.
Barrett, E.C., M.I. McBurney, and E.D. Ciappio (2014). ω-3 fatty acid supplementation as a potential therapeutic aid for the recovery from mild traumatic brain injury/concussion. Adv. Nutr. 5:268–277.
Barros, M.P., S.C. Poppe, and E.F. Bondan (2014). Neuroprotective properties of the marine carotenoid astaxanthin and omega-3 fatty acids, and perspectives for the natural combination of both in krill oil. Nutrients 6:1293–1317.
Begtrup, K.M., A.E. Krag, and A.-M. Hvas (2017). No impact of fish oil supplements on bleeding risk: A systematic review. Danish Med. J. 64:5.
Black, K.E., O.C. Witard, D. Baker, P. Healey, V. Lewis, F. Tavares, S. Christensen, T. Pease, and B. Smith (2018). Adding omega-3 fatty acids to a protein-based supplement during pre-season training results in reduced muscle soreness and the better maintenance of explosive power in professional Rugby Union players. Eur. J. Sport Sc. 18:1357–1367.
Bradberry, J.C., and D.E. Hilleman (2013). Overview of omega-3 fatty acid therapies. Pharmacy and therapeutics. 38:681–691.
Cook, R.L., H.M. Parker, C.E. Donges, N.J. O’Dwyer, H.L. Cheng, K.S. Steinbeck, E.P. Cox, J.L. Franklin, M.L. Garg, and H.T. O’Connor (2019). Omega-3 polyunsaturated fatty acids status and cognitive function in young women. Lipids Health Dis. 18:194.
Davinelli, S., G. Corbi, S. Righetti, E. Casiraghi, F. Chiappero, S. Martegani, R. Pina, L. De Vivo, A.P. Simopoulos, and G. Scapagnini (2019). Relationship between distance run per week, omega-3 index, and arachidonic acid (AA)/eicosapentaenoic acid (EPA) ratio: An observational retrospective study in non-elite runners. Front. Physiol. 10:487.
Davinelli, S., M. Intrieri, G. Corbi, and G. Scapagnini (2020). Metabolic indices of polyunsaturated fatty acids: Current evidence, research controversies, and clinical utility. Crit. Rev. Food Sci. Nutr. 1–16.
Drobnic, F., F. Rueda, V. Pons, M. Banquells, B. Cordobilla, and J.C. Domingo (2017). Erythrocyte omega-3 fatty acid content in elite athletes in response to omega-3 supplementation: A dose-response pilot study. J. Lipids. 1472719.
European Food Safety Authority (2012). Scientific opinion on the tolerable upper intake level of eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA) and docosapentaenoic acid (DPA). EFSA J. 10:2815.
Flock, M.R., A.C. Skulas‐Ray, W.S. Harris, T.D. Etherton, J.A. Fleming, and P.M. Kris‐Etherton (2013). Determinants of erythrocyte omega‐3 fatty acid content in response to fish oil supplementation: A dose–response randomized controlled trial. J. Am. Heart Assoc: Cardiovascular and Cerebrovascular Disease. 2:6.
Gerling, C.J., K. Mukai, A. Chabowski, G.J.F. Heigenhauser, G.P. Holloway, L.L. Spriet, and S. Jannas-Vela (2019). Incorporation of omega-3 fatty acids into human skeletal muscle sarcolemmal and mitochondrial membranes following 12 weeks of fish oil supplementation. Front. Physiol. 10:348.
Ghasemifard, S., G.M. Turchini, and A.J. Sinclair (2014). Omega-3 long chain fatty acid “bioavailability”: A review of evidence and methodological considerations. Progr. Lipid Res. 56:92–108.
Global Organization for EPA and DHA (2014). Omega-3 global intake recommendations by country. https://goedomega3.com/intake-recommendations.
Harris, W.S. (2007). Omega-3 fatty acids and cardiovascular disease: A case for omega-3 index as a new risk factor. Pharmacol. Res. 55:217–223.
Harris, W.S., and R.M. Thomas (2010). Biological variability of blood omega-3 biomarkers. Clin. Biochem. 43:338–340.
Heaton, L.E., J.K. Davis, E.S. Rawson, R.P. Nuccio, O.C. Witard, K.W. Stein, K. Baar, J.M. Carter, and L.B. Baker (2017). Selected in-season nutritional strategies to enhance recovery for team sport athletes: A practical overview. Sports Med. 47:2201–2218.
Lawson, L.D., and B.G. Hughes (1988). Absorption of eicosapentaenoic acid and docosahexaenoic acid from fish oil triacylglycerols or fish oil ethyl esters co-ingested with a high-fat meal. Biochem. Biophys, Res. Commun. 156:960–963.
Lewis, N.A., D. Daniels, P.C. Calder, L.M. Castell, and C.R. Pedlar (2020). Are there benefits from the use of fish oil supplements in athletes? A systematic review. Adv. Nutr. 11:1300-1314.
Liu, L., N. Bartke, H. Van Daele, P. Lawrence, X. Qin, H.G. Park, K. Kothapalli, A. Windust, J. Bindels, Z. Wang, and J.T. Brenna (2014). Higher efficacy of dietary DHA provided as a phospholipid than as a triglyceride for brain DHA accretion in neonatal piglets. J. Lipid Res. 55:531–539.
McGlory, C., S.L. Wardle, L.S. Macnaughton, O.C. Witard, F. Scott, J. Dick, J.G. Bell, S.M. Phillips, S.D.R. Galloway, D.L. Hamilton, and K.D. Tipton (2016). Fish oil supplementation suppresses resistance exercise and feeding-induced increases in anabolic signaling without affecting myofibrillar protein synthesis in young men. Physiol. Rep. 4:6.
McGlory, C., P.C. Calder, and E.A. Nunes (2019). The influence of omega-3 fatty acids on skeletal muscle protein turnover in health, disuse, and disease. Front. Nutr. 6:144.
Metherel, A.H., and R.P. Bazinet (2019). Updates to the n-3 polyunsaturated fatty acid biosynthesis pathway: DHA synthesis rates, tetracosahexaenoic acid and (minimal) retroconversion. Progr. Lipid Res. 76:101008.
Mickleborough, T.D. (2013). Omega-3 polyunsaturated fatty acids in physical performance optimization. Int. J. Sport Nutr Exerc. Metab. 23:83–96.
Mills, J.D., K. Hadley, and J.E. Bailes (2011). Dietary supplementation with the omega-3 fatty acid docosahexaenoic acid in traumatic brain injury. Neurosurgery 68:474–481.
Neubronner, J., J.P. Schuchardt, G. Kressel, M. Merkel, C. von Schacky, and A. Hahn (2011). Enhanced increase of omega-3 index in response to long-term n-3 fatty acid supplementation from triacylglycerides versus ethyl esters. Eur. J. Clin. Nutr. 65:247–254.
Nichols, P.D., A. McManus, K. Krail, A.J. Sinclair, and M. Miller (2014). Recent advances in omega-3: health benefits, sources, products and bioavailability. Nutrients 6:3727–3733.
Oliver, J.M., K.M. Kirk, D.A. Gable, J.T. Repshas, T.A. Johnson, U. Andreasson, N. Norgren, K. Blennow, and H. Zetterberg (2016). Effect of docosahexaenoic acid on a biomarker of head trauma in american football. Med. Sci. Sports Exerc. 48:974–982.
Oliver, J.M., A.J. Anzalone, and S.M. Turner (2018). Protection before impact: The potential neuroprotective role of nutritional supplementation in sports-related head trauma. Sports Med. 48:39–52.
Philpott, J.D., O.C. Witard, and S.D.R. Galloway (2019). Applications of omega-3 polyunsaturated fatty acid supplementation for sport performance. Res. Sports Med. 27:219–237.
Plourde, M., and S.C. Cunnane (2007). Extremely limited synthesis of long chain polyunsaturates in adults: Implications for their dietary essentiality and use as supplements. Appl. Physiol. Nutr. Metab. 32:619–634.
Ritz, P.P., M.B. Rogers, J.S. Zabinsky, V.E. Hedrick, J.A. Rockwell, E.G. Rimer, S.B. Kostelnik, M.W. Hulver, and M.S. Rockwell (2020). Dietary and biological assessment of the omega-3 status of collegiate athletes: a cross-sectional analysis. PLoS One. 15:e0228834.
Schuchardt, J.P., J. Neubronner, G. Kressel, M. Merkel, C. von Schacky, and A. Hahn (2011). Moderate doses of EPA and DHA from re-esterified triacylglycerols but not from ethyl-esters lower fasting serum triacylglycerols in statin-treated dyslipidemic subjects: Results from a six month randomized controlled trial. Prostaglandins Leukotrienes and Essential Fatty Acids. 85:381–386.
Schuchardt, J.P., and A. Hahn (2013). Bioavailability of long-chain omega-3 fatty acids. Prostaglandins, Leukotrienes and Essential Fatty Acids. 89:1–8.
Shahidi, F., and P. Ambigaipalan (2018). Omega-3 polyunsaturated fatty acids and their health benefits. Ann. Rev. Food Sci. Techn. 9:345–381.
Simopoulos, A.P. (2002). The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomed. Pharmacother. 56:365–379.
Siscovick D.S., T.A. Barringer, A.M. Fretts, J.H.Y. Wu, A.H. Lichtenstein, R.B. Costello, P.M. Kris-Etherton, T.A. Jacobson, M.B. Engler, H.M. Alger, L.J. Appel, and D. Mozaffarian (2017). Omega-3 polyunsaturated fatty acid (fish oil) supplementation and the prevention of clinical cardiovascular disease. Circulation 135:e867–e884.
Tepsic, J., V. Vucic, A. Arsic, V. Blazencic-Mladenovic, S. Mazic, and M. Glibetic (2009). Plasma and erythrocyte phospholipid fatty acid profile in professional basketball and football players. Eur. J. Appl. Physiol. 107:359–365.
Vannice, G., and H. Rasmussen (2014). Position of the Academy of Nutrition and Dietetics: Dietary fatty acids for healthy adults. journal of the academy of nutrition and dietetics. 114:136–153.
von Schacky, C., M. Kemper, R. Haslbauer, and M. Halle (2014). Low Omega-3 Index in 106 German elite winter endurance athletes: A pilot study. Int. J. Sport Nutr. Exerc. Metab. 24:559–564.
Walker, A.J., B.A. McFadden, D.J. Sanders, M.M. Rabideau, M.L. Hofacker, and S.M. Arent (2019a). Biomarker response to a competitive season in division i female soccer players. J. Strength Cond. Res. 33:2622-2628.
Walker, R.E., K.H. Jackson, N.L. Tintle, G.C. Shearer, A. Bernasconi, S. Masson, R. Latini, B. Heydari, R.Y. Kwong, M. Flock, P.M. Kris-Etherton, A. Hedengran, R.M. Carney, A. Skulas-Ray, S.S. Gidding, A. Dewell, C.D. Gardner, S.M. Grenon, B. Sarter, J.W. Newman, T.L. Pederson, M.K. Larson, and W.S. Harris. (2019b). Predicting the effects of supplemental EPA and DHA on the omega-3 index. Am. J. Clin. Nutr. 110:1034-1040.
Wilson, P.B., and L.A. Madrigal (2016). Associations between whole blood and dietary omega-3 polyunsaturated fatty acid levels in collegiate athletes. Int. J. Sport Nutr. Exerc. Metab. 26:497–505.
Witard, O.C., and Davis J.K. (2021). Omega-3 fatty acids for training adaptation and exercise recovery: a muscle-centric perspective in athletes. SSE #211






