SSE #223: HIDRATAÇÃO PARA A SAÚDE E BEM-ESTAR
Publicado em
March 2022
Autor
Lindsay B. Baker, PhD; Colin D. Rehm, PhD, MPH; and Michelle A. King, PhD
PONTOS-CHAVE:
- Reduções agudas no conteúdo de água corporal (por exemplo, 1-2% de deficiência de massa corporal) podem ter um efeito prejudicial na performance física e cognitiva, e no humor, mas os efeitos da ingestão habitual de líquidos nos resultados da saúde em geral e do bem-estar ainda não são bem compreendidos.
- Apesar da grande variação na ingestão habitual de líquidos, a hipohidratação crônica é rara devido aos mecanismos homeostáticos que mantêm a osmolalidade plasmática. Mesmo dentro da faixa normal de hidratação (< 1% de deficiência de massa corporal), indivíduos que normalmente ingerem um baixo volume de líquidos (< 1-2 L/dia) podem estar em um estado crônico de reabsorção renal de água (sub-hidratação), estimulado pelas altas concentrações da arginina vasopressina na circulação.
- Novas pesquisas sugerem que a sub-hidratação pode estar associada com um maior risco para certas condições agudas e doenças crônicas.
- Há dados relativamente sólidos provenientes de ensaios controlados randomizados sugerindo que aumentar a ingestão habitual de líquidos pode reduzir o risco de episódios recorrentes de pedras no rim e de infecções no trato urinário.
- A restrição de líquidos pode ser um fator de risco para dores de cabeça e para a constipação funcional, mas há poucas evidências de que aumentar a ingestão de líquidos em indivíduos que ingerem um baixo volume de líquido possa prevenir ou tratar estas condições.
- Para outros cenários relacionados à saúde, incluindo a doença renal crônica, a síndrome metabólica e a doença cardiovascular, estudos epidemiológicos observacionais compõem a maior parte das pesquisas existentes. Este fato dificulta o delineamento de relações causais diretas entre a ingestão de líquidos e o risco para doenças, devido a questões envolvendo fatores de confusão e a medição do estado de hidratação.
INTRODUÇÃO
Ao longo das últimas muitas décadas, houve um considerável interesse científico em relação ao entendimento de deficiências agudas de água corporal através da transpiração induzida pelo exercício e os efeitos associados na fisiologia e performance. Apesar disso, os efeitos dos hábitos diários de ingestão de líquidos no bem-estar em geral e as consequências para a saúde ainda não estão bem compreendidos. Isto porque, além dos casos de doenças ou em exercícios vigorosos, a hipohidratação evidente é normalmente prevenida pelos mecanismos homeostáticos para a manutenção da osmolalidade do plasma e o balanço hídrico por meio da conservação renal de água.
Contudo, novas hipóteses sugerem que a ingestão habitual de líquidos abaixo da quantidade ideal pode estar associada com um maior risco para certas condições agudas e doenças crônicas (Kavouras, 2019; Perrier, 2017). O objetivo deste artigo do Sports Science Exchange é fornecer uma breve revisão da literatura e resumir as limitações e pesquisas futuras que investigam a hidratação na saúde e no bem-estar.
TERMINOLOGIA RELACIONADA À HIDRATAÇÃO E PROCESSOS REGULATÓRIOS
Um resumo da terminologia envolvendo o estado de hidratação e os processos de hidratação está ilustrado na Figura 1. Quando existe uma discrepância considerável entre a ingestão e a perda de líquidos (> ±2% da água corporal total (ACT) ou ±1% da massa corporal), este desequilíbrio leva a alterações no estado de hidratação – por exemplo, a deficiência (hipohidratação) ou o excesso (hiper-hidratação) de água corporal. Contudo, nas nossas vidas diárias normais a manutenção da ACT (euhidratação) é normalmente atingida através de uma regulação severa da osmolalidade plasmática, que é a concentração dos solutos dissolvidos (principalmente o sódio) nos compartimentos de líquidos extracelulares. Aumentos na osmolalidade do plasma estimulam a secreção da arginina vasopressina (AVP), resultando na reabsorção renal de água (desafio antidiurético), caracterizado pela redução no volume de urina e frequência urinária e pela maior concentração da urina. A sensação de sede também é estimulada com aumentos na AVP, apesar de em um limiar osmótico maior do que aquele dos mecanismos renais de conservação de água (Robertson, 1984).
Pelas razões que acabamos de discutir, o processo de hidratação é melhor avaliado através do volume e da concentração da urina. A AVP plasmática (ou a copeptina, sua substituta) pode também refletir em alterações no processo de hidratação, mas os valores-limite são difíceis de serem estabelecidos devido a uma variabilidade biológica significativa e à necessidade em responder aos estímulos não-osmóticos (náusea, postura, dor, temperatura e fatores circadianos), assim como aos estímulos osmóticos. Enquanto não há um padrão-ouro universalmente aceito para avaliar o estado de hidratação, os melhores indicadores para a hipohidratação e a hiper-hidratação excessivas são a osmolalidade plasmática e a massa corporal (Cheuvront & Kenefick, 2016). Desta forma, biomarcadores urinários elevados não são necessariamente um indicativo de hipohidratação. Por sua vez, o termo sub-hidratação tem sido proposto para descrever o fenômeno em indivíduos que normalmente ingerem um baixo volume de líquidos, no qual os mecanismos homeostáticos da água foram ativados (como indicado pelos biomarcadores urinários e AVP elevados), na ausência de deficiência de água corporal, hiperosmolalidade ou sensação de sede (Kavouras, 2019).

Figura 1: Variações estimadas nos biomarcadores utilizados para descrever o estado de hidratação e o processo de hidratação. Alterações na água corporal total fora do intervalo de euhidratação são indicados pelas alterações significativas na osmolalidade plasmática (e sódio) e massa corporal, enquanto reajustes renais mediados pela AVP estimulam a conservação de água ou perda para regular a osmolalidade do plasma e balanço hídrico.
Tradução da figura:
ESTADO DE HIDRATAÇÃO // Sede / Sódio Plasmático / Osmolalidade Plasmática / Massa Corporal / Água Corporal Total
gain = ganho / loss = perda
PROCESSO DE HIDRATAÇÃO // Concentração Urina 24h / Volume e Frequência Urinária 24h / Vasopressina ou Copeptina Plasmática
Desafio diurético (indivíduos que ingerem alta quantidade de líquidos)
Hidratação ideal? // color = coloração / voids = esvaziamentos da bexiga
Desafio antidiurético (indivíduos que ingerem baixa quantidade de líquidos/ “sub-hidratados”)
color = coloração
HIPERHIDRATAÇÃO/ HIDRATAÇÃO EXCESSIVA
EUHIDRATAÇÃO
DESIDRATAÇÃO /HIPOHIDRATAÇÃO / REIDRATAÇÃO
USG, gravidade específica da urina. Alterações retiradas de Perrier et al. Eur J Nutr 2021; Sawka et al. 2005; Cheuvront et al. 2016
NECESSIDADES DE INGESTÃO DE LÍQUIDOS
A Autoridade Europeia para a Segurança dos Alimentos (EFSA) define como ingestão adequada de água o total de 2,5 L/dia para os homens e 2,0 L/dia para as mulheres (EFSA, 2010). De acordo com o Instituto de Medicina (IOM), a ingestão total de água recomendada é de 3,7 L/dia e 2,7 L/dia para homens e mulheres com idades entre 19 e 50 anos, respectivamente, valor baseado na ingestão média total de água proveniente da terceira Pesquisa Nacional de Exame de Saúde e Nutrição (NHANES III) (IOM, 2005). A ingestão total de água inclui a água dos alimentos (normalmente ~20% da ingestão total de água), assim como o consumo de água pura e outras bebidas (IOM, 2005). É importante reiterar que as diretrizes para a ingestão adequada de água representam o valor médio para uma população. As diretrizes não têm intenção de sugerir que 3,7 L/dia (homens) e 2,7 L/dia (mulheres) sejam quantidades apropriadas para todas as pessoas (Sawka et al., 2005). Devido a uma variação significativa na perda diária de água, tanto entre os indivíduos como a própria variabilidade individual, não há uma recomendação para a ingestão diária de líquidos que sirva para todos.
Diversos estudos mostraram que, em adultos com hábitos livres, a osmolalidade plasmática é similar apesar das diferentes quantidades de ingestão habitual de líquidos (IOM, 2005; Perrier et al., 2012). Então, apesar de ≥ 40% dos adultos americanos consumirem menor quantidade total de água que o volume médio recomendado pelo IOM (Vieux et al., 2020), a maioria dos adultos saudáveis não está sistematicamente hipohidratada. Para alguns indivíduos, ingerir uma menor quantidade de líquidos em relação ao valor médio é adequado para atingir as suas necessidades de líquidos (com base no tamanho corporal, dieta etc.), enquanto outros podem ser considerados indivíduos que normalmente ingerem um baixo volume de líquidos. Observações de pessoas com hábitos livres relatam que indivíduos que ingerem um baixo volume de líquidos apresentam concentrações elevadas de biomarcadores urinários e da AVP (ou copeptina), um indicativo de desafio antidiurético, no qual a reabsorção renal da água é suficiente para prevenir a deficiência de ACT (Perrier et al., 2013). Dados epidemiológicos relacionando a AVP com marcadores de doenças levaram alguns pesquisadores a examinar os efeitos crônicos de saúde nestes indivíduos que ingerem um baixo volume de água. A próxima seção fornece uma revisão dos estudos visando abordar as duas questões no centro desta discussão: (1) a baixa ingestão habitual de água, na ausência de hipohidratação, está associada com consequências adversas? E (2) há evidências de que aumentar a ingestão de água ad libitum melhore a saúde, o bem-estar ou reduza o risco de doenças (ou biomarcadores alternativos, quando não estavam disponíveis parâmetros sólidos para o risco de doenças)?
REVISÃO DA LITERATURA DE DETERMINADOS CENÁRIOS DE SAÚDE E BEM-ESTAR
Sistema Urinário
Infecção do Trato Urinário (ITU). A ITU é uma forma de cistite causada por uma infecção bacteriana e está entre as infecções ambulatoriais mais comuns nos Estados Unidos. Aproximadamente metade das mulheres adultas terão pelo menos uma ITU ao longo da vida, 27% das quais terão recorrência confirmada dentro de 6 meses. Diversos estudos transversais e casos-controle investigaram o efeito da ingestão habitual de líquidos no risco para ITU em mulheres. Alguns estudos (Nygaard & Linder, 1997; Vyas et al., 2015) encontraram que uma menor ingestão diária de líquidos (≤ 1,0-1,4 L/dia) estava associada com um maior risco para ITU. Um menor número de esvaziamentos da bexiga (< 3-6/dia) ou a micção tardia, pode também ser um fator de risco para ITU (Vyas et al., 2015).
Aumentar a ingestão de líquidos eleva o fluxo de urina, o que se acredita ajudar a prevenir o desenvolvimento de ITU pelo enxágue das bactérias do trato urinário (Figura 2). No entanto, até recentemente havia poucas evidências empíricas de que aumentar a ingestão habitual de líquidos de indivíduos que normalmente ingerem um baixo volume de líquidos poderia reduzir o risco de ITU. Em 2018, um ensaio controlado randomizado (ECR) avaliou 140 mulheres no período pré-menopausa que sofriam com cistites recorrentes e foram solicitadas a aumentar sua ingestão diária de água ou a manter sua ingestão habitual de líquidos, por 12 meses. Houve uma redução de 48% em episódios de ITU após o aumento na ingestão total de líquidos de 1,1 para 2,8 L/dia (Hooton et al., 2018). Um benefício secundário importante foi a redução do uso de antibióticos utilizados para tratar a ITU nas mulheres que aumentaram a ingestão de líquidos. Até o momento, nenhum estudo investigou os efeitos do maior volume da ingestão de líquidos no risco para ITU incidente.
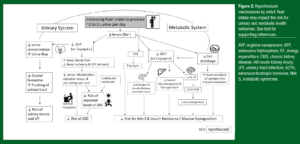
Figura 2: Mecanismos sugeridos pelos quais a ingestão de líquidos pode impactar o risco para consequências urinárias e metabólicas na saúde. Veja texto para referências adicionais.
AVP, arginina vasopressina; ATP, trifosfato de adenosina; GE, gasto energético; DCR, doença renal crônica; LRA, lesão renal aguda; ITU, infecção do trato urinário; ACTH, hormônio adrenocorticotrófico; S Met, síndrome metabólica.
Tradução da Figura (esquerda para a direita):
Sistema Urinário / EM CINZA: Aumentar a ingestão de líquidos para produzir ~2-3 L de urina por dia / SISTEMA METABÓLICO
↓ Concentração urina / ↑ Fluxo de urina
↓ Formação de cristais / ↑ Enxague do trato urinário
↓ Risco de pedras nos rins e ITU
↓ AVP (ou Copeptina)
↑ Fluxo sanguíneo renal / ↓ Isquemia renal e demanda de ATP
↓ Inflamação renal, estresse oxidativo e ácido úrico circulante
Intervalos para resfriamento e descanso
População em geral // ↓ Risco de episódios repetitivos de LRA
↓ Risco de DCR
↓ [Na+] sérico
↑ GE
↑ Lipólise
↓ Liberação de Glucagon e Insulina (ilhotas pancreáticas)
↓ Risco para S Met e Resistência à Insulina / Desregulação de Glicose
↓ AVP (ou Copeptina)
↓ Gliconeogênese e Glicogenólise hepática
↓ ACTH
↓ Cortisol
↓ Gliconeogênese
↓ Encolhimento celular
↑ Sensibilidade à insulina / ↓ Hiperglicemia / ↔ Metabolismo lipídico
IMPORTANTE: hipotetizado
Pedras no Rim. Pedras nos rins são depósitos rígidos de minerais e sais (principalmente o oxalato de cálcio misturado com o fosfato de cálcio) que se formam quando a urina se torna excessivamente supersaturada. A prevalência no decorrer de uma vida de pedras nos rins é de aproximadamente 9% nos Estados Unidos e até 15% em outros países, e há uma tendência de um maior incômodo causado pelas pedras nos rins ao longo das últimas décadas (Romero et al., 2010). Fatores nutricionais, incluindo a ingestão de líquidos, podem influenciar na formação das pedras. Por exemplo, em estudos observacionais uma menor ingestão de líquidos (< 1,8 L/dia) (Linder et al., 2013), uma menor produção de urina (~1,0 L/dia) (Borghi et al., 1996) e uma maior osmolalidade urinária (> 500-580 mOsm/kg) (Kavouras et al., 2021) foram associados com um maior risco de formação recorrente de pedra nos rins.
Também há evidências provenientes de ECRs de que aumentar a ingestão de líquidos de pacientes com histórico de pedras nos rins pode ser uma estratégia efetiva na redução do risco de recorrência (Borghi et al., 1996). Automaticamente, é provável que a diluição da urina com o aumento da ingestão de líquidos ajude a prevenir a supersaturação e formações de cristais. O maior fluxo de urina ajuda a enxaguar o trato urinário, o que também pode ser útil na prevenção de formação de pedras nos rins (Figura 2). Uma revisão sistemática de ECRs relatou que uma maior produção de urina (> 2,5 L/dia) diminuiu o risco a longo-prazo de recorrência de pedra nos rins aproximadamente em 60% (Fink et al., 2009). Então, as diretrizes atuais para a prevenção secundária de pedras nos rins recomendam que os indivíduos que formam pedras mantenham uma ingestão de líquidos suficiente para produzir um volume de urina ≥ 2,5-3,0 L/dia (Pearle et al., 2014; Skolarikos et al., 2015). Em respeito à prevenção primária, uma maior ingestão de líquidos (> 2,0 L/dia) foi associada com um menor risco de episódio de pedra nos rins em estudos observacionais (Xu et al., 2015), mas nenhum ECR examinou o papel da ingestão de líquidos na prevenção da formação de pedras pela primeira vez.
Doença Renal Crônica (DRC). A DRC é definida como uma perda progressiva da função renal e foi reconhecida como um dos principais problemas de saúde pública, com uma prevalência total de aproximadamente 13%, em todos os estágios da doença. O sistema renal tem papéis vitais em regular o balanço hidroeletrolítico e em filtrar o sangue para remover os resíduos através da urina, enquanto retém nutrientes importantes. Um declínio da função renal é caracterizado por uma redução na estimativa da taxa de filtração glomerular (eTFG < 60 ml/min/1,73 m2) e pelo vazamento de proteínas na urina (albuminúria).
Estudos observacionais mostram que uma ingestão de líquidos maior (3,2 L/dia) e um maior volume de urina (≥ 3,0 L/dia) reduzem as chances de declínio renal entre homens e mulheres saudáveis no geral (Clark et al., 2011; Strippoli et al., 2011). Acredita-se que a ingestão de líquidos previna o declínio da função renal pela supressão da AVP. Estudos observacionais com homens e mulheres saudáveis (Clark et al., 2011; El Boustany et al., 2018) encontraram que concentrações plasmáticas maiores de AVP, ou de copeptina, estavam associadas com um risco maior para declínio da função renal. Apesar do aumento da ingestão diária de água poder apresentar o efeito de reduzir a AVP e a copeptina, não está claro se isto reduz o risco de doença. Apenas um ECR foi conduzido no qual tanto a AVP quanto os marcadores da função renal foram medidos. Apesar de um declínio nas concentrações plasmáticas de copeptina, o declínio na eTFG em um ano não variou significativamente entre pacientes no estágio 3 da DRC que foram aconselhados a aumentar a ingestão de água de 1,0 para 1,5 L/dia, e nos pacientes que foram solicitados a manter sua ingestão habitual (Clark et al., 2018). No entanto, problemas relacionados com a adesão à intervenção podem ter contribuído com o efeito nulo, já que a produção de urina no grupo “intervenção” foi apenas 0,6 L/dia maior que no grupo “controle”. Mais pesquisas são necessárias para demonstrar uma relação causal entre a sub-hidratação crônica, a AVP, e a DRC.
Diversos estudos ao longo da última década descreveram uma epidemia de DRC ocorrida pela costa do Pacífico na América Central. A DRC é uma das principais causas de morte nesta região dentre os homens em idade produtiva, em comunidades de baixa altitude (exemplo, agricultores, colhedores de cana-de-açúcar, oleiros). Acredita-se que essa epidemia, denominada nefropatia mesoamericana, seja causada por lesão renal aguda (LRA) recorrente pela exposição repetitiva ao estresse térmico extremo, trabalho físico extenuante e hipohidratação (Weiner et al., 2013).
Os possíveis mecanismos pelos quais a ingestão de líquidos possa impactar o risco de DRC estão ilustrados na Figura 2. Resumindo, o exercício e o estresse térmico causam a redistribuição do fluxo sanguíneo para longe do córtex renal, o que pode prejudicar a distribuição de oxigênio e por sua vez limitar a produção de trifosfato de adenosina (ATP), necessário para o funcionamento normal da célula. A hipohidratação exacerba o risco de lesão renal devido à maior demanda do ATP por água e à conservação eletrolítica. Em conjunto, estes fatores podem levar a uma cascata de eventos que promovem a inflamação e o estresse oxidativo, aumentando, portanto, o risco de esclerose glomerular e uma redução no número de néfrons funcionantes (Chapman et al., 2021). É importante notar, contudo, que os mecanismos propostos são em sua maioria derivados de dados animais. Mais pesquisas são necessárias para estabelecer os fundamentos diretos para as LRA recorrentes relacionadas ao calor na etiologia da DRC em trabalhadores braçais.
Metabolismo
Síndrome Metabólica (SMet). A SMet se refere à ocorrência concomitante de diversas condições que aumentam o risco para doenças cardiovasculares, Diabetes Mellitus tipo II (DT2) e AVC, incluindo a resistência à insulina, obesidade, dislipidemia e hipertensão (Huang, 2009). A hipohidratação crônica tem sido associada a um maior risco para SMet e seus componentes. Por exemplo, possíveis indicadores de hipohidratação, como o sódio sérico, volume de urina e osmolalidade, foram associados com a prevalência de obesidade, alta circunferência da cintura, resistência à insulina, baixos níveis de lipoproteínas de alta densidade (HDL), hipertensão e síndrome metabólica (Stookey et al., 2020). De maneira semelhante, um ECR encontrou que a hipohidratação induzida experimentalmente (-1,6% de perda de massa corporal) prejudicou de maneira aguda a resposta da glicose sanguínea a 3 dias de baixa ingestão total de água (osmolalidade do plasma ~298 mOsm/kg) em pessoas com DT2 (Johnson et al., 2017), apesar destes resultados apresentarem a possibilidade de não serem reproduzidos em voluntários saudáveis (Carroll et al., 2019). Além disso, outro ECR com adultos saudáveis não encontrou alterações na glicose sanguínea de jejum ou nas concentrações de AVP, com um adicional de 1,1 L/dia de água por 12 semanas (Nakamura et al., 2020).
Apesar dos ECRs não terem elucidado os efeitos da ingestão de líquidos na SMet, mecanismos implícitos sustentando as associações mencionadas anteriormente têm sido cuidadosamente investigados. Quando a AVP é normalmente ativada para manter a osmolalidade do plasma, isto pode levar a efeitos negativos na regulação da glicose e diabetes. Efeitos negativos da secreção crônica de AVP na regulação da glicose podem ter origem no estímulo da AVP na gliconeogênese e glicogenólise no fígado através do receptor de vasopressina 1a (V1aR) (Keppens & de Wulf, 1979; Whitton et al., 1978) e na liberação de ambos glucagon e insulina através do receptor de vasopressina 1b (V1bR) nas ilhotas pancreáticas (Abu-Basha et al., 2002). O hormônio adrenocorticotrófico (ACTH) é liberado após ativação da V1bR na glândula pituitária anterior via AVP. Esta ação eleva a secreção de cortisol adrenal levando a gliconeogênese, que com o tempo pode ser prejudicial e indesejada para uma variedade de sistemas nos órgãos (Perrier et al., 2021). Além disso, aumentos na concentração sérica de sódio promovem encolhimento celular, possivelmente predispondo os indivíduos à obesidade através de respostas fisiológicas como a maior regulação da proteólise e glicogenólise, que pode servir de gatilho para a resistência à insulina (Lang et al., 1998) (Figura 2).
Como respaldo a estes estudos mecanísticos, as altas concentrações de copeptina no plasma têm sido associadas com a resistência à insulina, Diabetes Mellitus, e SMet (Enhörning et al., 2010; Saleem et al., 2009). Outros estudos também demonstraram uma relação entre a copeptina, a Diabetes Mellitus e a obesidade, mas não a todo o conjunto de condições da SMet (Enhörning et al., 2013; Then et al., 2015). No entanto, devido estes estudos serem em sua maioria estudos transversais, os achados precisam ser reproduzidos em estudos prospectivos e de preferência ECRs.
O papel da hidratação na obesidade e consequentemente na SMet pode também decorrer dos efeitos da ingestão de líquidos no gasto energético (GE) e na perda de peso. Algumas evidências sugerem que a ingestão de aproximadamente 500 ml de água aumenta o GE, com uma pequena contribuição devido a uma maior termogênese para o aquecimento da água à temperatura corporal (Boschmann et al., 2003). Contudo, quando outros trabalhos tentaram replicar estes resultados, o GE não aumentou após a ingestão de água destilada ou solução salina (Brown et al., 2006). Estudos iniciais também apresentaram resultados contraditórios nas alterações do GE quando a água foi utilizada como um controle para observar mudanças no GE após intervenção calórica. Mais recentemente, uma simulação de ECR controlado mostrou que ingerir água purificada (500ml) levou a apenas pequenos aumentos no GE que não foram diferentes de controles simulados (Charrière et al., 2015). Os autores concluíram que a ingestão de água purificada não resulta em termogênese ou em oxidação da gordura. Inconsistências em trabalhos com o GE podem ser reflexo de diferenças metodológicas ou de limitações em relação às medidas.
Apesar do efeito da água no GE parecer mínimo, estudos de intervenção sugerem que quando a água foi consumida anteriormente à cada refeição, isto levou à maior perda de peso do que a dieta hipocalórica isoladamente (Dennis et al., 2010). Além disso, a ingestão de mais de um litro de água por dia foi associada com riscos menores de apresentar sobrepeso em uma população chinesa. Os autores relataram que cada xícara de água consumida foi associada com uma redução de 6,5% (homens) e 8,4% (mulheres) no risco de apresentar sobrepeso (Pan et al., 2020). Contudo, o efeito de consumir água pura em um padrão de dieta e ingestão calórica total é inconsistente nos ensaios (Kant & Graubard, 2018). Deve-se notar que substituir bebidas calóricas por água possivelmente pode ser uma estratégia de perda de peso (Tate et al., 2012). Enquanto estes resultados sugerem a ingestão de água pura como uma possível estratégia para a prevenção de ganho de peso, ou aumento da quantidade de peso perdido, estes estudos apresentam diversas limitações.
Sistema Cardiovascular.
Doença Cardiovascular (DCV). As doenças cardiovasculares são um grupo de distúrbios do coração e vasos sanguíneos e é a causa número um de morbidade e mortalidade nos Estados Unidos (Virani et al., 2020) e a principal causa de mortes em todo o mundo (WHO, 2021). Consequentemente, maneiras práticas e de baixo custo para reduzir os fatores de risco para DCV e condições relacionadas são de interesse da saúde pública. A hipohidratação foi relacionada com uma maior chance para fatores de risco cardiovasculares e condições associadas em estudos transversais; no entanto, ECRs são poucos. Pesquisas pré-clínicas sugerem que a hipohidratação pode prejudicar a função endotelial, aumentar a atividade nervosa simpática e exacerbar a intolerância ortostática, contribuindo para a regulação prejudicada da pressão sanguínea e função vascular (Watso & Farquhar, 2019). Além disso, a hipohidratação estimula a AVP e consequentemente a liberação de glicocorticoides que estimulam a quinase 1 sérica e também a induzida por glicocorticoide, possivelmente motivando o desenvolvimento de hipertensão, obesidade, trombose, AVC e fibrose cardíaca (Lang et al., 2017).
Como respaldo, um estudo prospectivo coorte demonstrou que aumentar a ingestão de água pura reduziu o risco de doença cardiovascular (Chan et al., 2002), mas esta análise foi conduzida nas casas de famílias Adventistas do Sétimo Dia na Califórnia, tornando difícil generalizar para outras populações. Em contraste, estudos prospectivos adicionais não observaram uma associação entre a ingestão de água, ou total de líquidos e doença isquêmica do coração, AVC, mortalidade por todas as causas ou mortalidade cardiovascular (Kant & Graubard, 2017; Palmer et al., 2014).
Intolerância Ortostática. A intolerância ortostática é a habilidade de manter uma postura ereta contra a gravidade através da manutenção da perfusão cerebral, prevenindo a síncope (por exemplo, desmaios ou perda temporária de consciência geralmente levando à queda). A síncope ocorre ao menos uma vez em 22% da população, e 9% destes indivíduos apresentam episódios recorrentes (Chen et al., 2003). Clinicamente, a hipotensão ortostática (postural) é definida como uma queda na pressão sanguínea de mais de 20 mmHg da pressão sistólica (ou 10 mmHg da diastólica) ao se levantar (Kaufmann, 1996) ou ao se inclinar com a cabeça erguida em pelo menos 60°. A inclinação da cabeça para cima e a pressão negativa da parte inferior do corpo são métodos experimentais comuns utilizados para avaliar a tolerância aos estressores ortostáticos. A hipotensão ortostática pode resultar de uma variedade de doenças ou medicamentos, mas também pode resultar de causas não-neurogênicas, o que inclui redução do volume sanguíneo, vasodilatação e dano cardíaco (Mathias & Kimber, 1998). Tratamentos não-farmacológicos da hipotensão ortostática incluem estimular uma alta ingestão de sal (de 6 a 9 g de cloreto de sódio/dia) e de líquidos (2-3 L/dia) para a expansão crônica do volume intravascular (Arnold & Shibao, 2013).
Uma sessão aguda de exercícios prejudica a tolerância ortostática (Eichna et al., 1947) e mesmo baixos níveis de hipohidratação podem contribuir para a intolerância ortostática (Davis & Fortney, 1997). Contudo, um estudo observacional inicial não demonstrou diferenças no estado de hidratação, como medido pela porcentagem de perda de massa corporal e volume do plasma, entre indivíduos que apresentaram colapso e aqueles que não apresentaram, após uma prova de ultra-endurance (Holtzhausen & Noakes, 1995). Apesar de haver alguns casos extremos em que a hipotensão pós-exercício pode se tornar sintomática, a maioria das síncopes pós-exercício é provavelmente mediada neurologicamente (Halliwill et al., 2014). A ingestão de água é sugerida como uma medida contra a síncope pós-exercício (Krediet et al., 2004). Contudo, isto é principalmente devido ao efeito da ingestão de água na resposta pressora, ao invés do seu efeito no estado de hidratação (Halliwill et al., 2014). Em concordância com isto, a ingestão de água (~500 ml) (Davis & Fortney, 1997; Jordan et al., 2000; Schroeder et al., 2002) melhorou medidas experimentais da tolerância ortostática (batimento cardíaco, pressão sanguínea, taquicardia, volume sistólico, inclinação com a cabeça erguida), mas nem todos os estudos relataram este benefício em indivíduos jovens saudáveis (Jordan et al., 2000).
Sistema Gastrointestinal
Um dos distúrbios gastrointestinais mais comuns mundo afora é a constipação idiopática crônica, com uma prevalência média de aproximadamente 16%. Estudos transversais sugerem que uma baixa ingestão de líquidos pode estar associada com a constipação em adultos (≤ 1,0-1,8 L/dia) (Yurtdas et al., 2020), assim como em crianças e adolescentes (~0,4-1,0 L/dia) (Boilesen et al., 2017). Além disso, um estudo de intervenção encontrou que uma semana de privação de líquidos (0,5 vs. 2,5 L/dia na semana anterior) foi associada com uma menor frequência de evacuação e menor peso das fezes em homens saudáveis (Klauser et al., 1990).
Há poucas evidências, no entanto, de que aumentar a ingestão de líquidos em indivíduos que consomem pouca quantidade de líquido afete a produção de fezes. Um ECR encontrou que uma maior ingestão de líquidos (1,0 a 2,1 L/dia) melhorou o efeito de uma dieta rica em fibras na frequência de evacuação em homens e mulheres com constipação funcional (Anti et al., 1998). Mas outros ECRs não encontraram efeitos da maior ingestão de água (1,0-1,2 a 1,6-1,8 L/dia) e/ou da maior produção de urina (~1,0 a 1,5-2,0 L/dia) no peso das fezes ou na frequência evacuatória em homens e mulheres saudáveis (Chung et al., 1999; Ziegenhagen et al., 1991). Assim, enquanto a desidratação excessiva do conteúdo intestinal pode endurecer as fezes, aumentar a ingestão de líquidos pode não melhorar a consistência das fezes, já que a maior parte da água é absorvida nos intestinos e qualquer excesso, posteriormente, excretado pelos rins.
Sistema Neurológico.
Dor de Cabeça. Dores de cabeça recorrentes estão entre os distúrbios mais comuns do sistema nervoso, afetando aproximadamente metade da população adulta globalmente. A dor de cabeça tensional é o distúrbio das dores de cabeça mais prevalente (42%), seguida pela enxaqueca (11%) e dor de cabeça diária crônica (3%). Mulheres são mais propensas a ter distúrbios de dores de cabeça, especialmente a enxaqueca. As dores de cabeça não são apenas dolorosas, mas uma das principais causas de anos perdidos devido à incapacitação.
Alguns estudos com restrição de líquidos sugerem que uma deficiência de 1,4-2,7% da massa corporal acumulada ao longo de 8-37 horas aumenta os sintomas das dores de cabeça (Armstrong et al., 2012; Shirreffs et al., 2004). Além disso, um estudo transversal com mulheres encontrou baixas taxas de incapacitação pela enxaqueca, severidade da dor, e frequência e duração das dores de cabeça em indivíduos com maior ingestão de água (2,1-2,3 L/dia) versus indivíduos com baixa ingestão (1,6-1,9 L/dia) (Khorsha et al., 2020). Enquanto a restrição de líquidos pode ser um fator de risco para a dor de cabeça, há poucos dados sobre o efeito da maior ingestão de líquidos como prevenção ou tratamento da dor de cabeça em pacientes com dores de cabeça recorrentes. Um pequeno ECR encontrou uma melhora considerável nas medidas subjetivas (Questionário de Qualidade de Vida Específico para Enxaqueca, do inglês Migraine-Specific Quality of Life questionnaire) quando pacientes homens e mulheres aumentaram sua ingestão de água de 1,7 para 2,6 L/dia por 3 meses, porém sem efeitos nas medidas objetivas, incluindo o número de dias com presença de dores de cabeça, ou uso de medicação (Spigt et al., 2012). Mais pesquisas são necessárias para elucidar o papel da hidratação nos distúrbios de dores de cabeça assim como os possíveis mecanismos de ação pelos quais a ingestão de líquidos poderia prevenir, ou tratar, estes sintomas.
Performance Cognitiva. O efeito da hipohidratação na performance cognitiva foi discutido em um artigo anterior da Sports Science Exchange (Wittbrodt & Barnes, 2020). Resumindo, uma hipohidratação leve (≥ 1% de deficiência de massa corporal) pode ter um efeito pequeno, mas significativamente prejudicial na performance cognitiva em geral. Danos cognitivos são mais prováveis com níveis mais altos de hipohidratação (> 2% de deficiência de massa corporal). Além disso, danos cognitivos são maiores na esfera de ordem superior (função executiva e atenção) do que simplesmente testes de reação baseados no tempo (Wittbrodt & Millard-Stafford, 2018).
Há poucas informações disponíveis sobre os efeitos de uma maior ingestão de líquidos feita de maneira experimental, acima da ingestão habitual. Alguns estudos investigaram os efeitos agudos da ingestão de 120-500 ml de água, com resultados contraditórios na performance cognitiva, medida de 2 a 50 minutos após a ingestão. Contudo, os efeitos podem ser modificados pelo nível da sensação de sede; isto é, melhoras na performance foram mais prováveis em indivíduos com alta taxa subjetiva de sede no momento da ingestão de água (Edmonds et al., 2013b; Rogers et al., 2001).
Humor. Assim como a performance cognitiva, o humor pode ter um impacto significativo no funcionamento do dia a dia e é um aspecto importante do bem-estar em geral. Pesquisas têm mostrado consistentemente que a hipohidratação de curto prazo (1,1-2,7% de deficiência de massa corporal) induzida pela restrição aguda de líquidos reduziu sentimentos de energia, vigor, estado de alerta, e habilidade de concentração e/ou aumentou a fadiga, cansaço, tensão e ansiedade (Armstrong et al., 2012; Pross et al., 2014; Shirreffs et al., 2004; Szinnai et al., 2005).
Menos se conhece sobre o efeito do aumento da ingestão de líquidos acima da ingestão basal ou habitual. Pequenos volumes de suplementação com água (120-500 ml) podem ter benefícios de curto-prazo (~2-20 min) no estado de alerta, mas não efeitos no humor de aproximadamente 25 a 50 minutos após a ingestão (Edmonds, et al., 2013a; Rogers et al., 2001). Além disso, um estudo relatou menor sensação de fadiga, mas nenhum impacto no estado de alerta após 3 dias de maior ingestão de água (1,0 a 2,5 L/dia) em indivíduos que consomem pouca quantidade de líquidos habitualmente (Pross et al., 2014). Os efeitos positivos da suplementação com a água no humor podem ser um resultado da inibição do reflexo orofaríngeo da sede (Figaro & Mack, 1997) e/ou do aumento temporário na atividade simpática e norepinefrina plasmática com ou sem aumentos na pressão sanguínea logo após ingestão de líquidos em indivíduos saudáveis (Schroeder et al., 2002; Scott et al., 2001).
OUTRAS CONSIDERAÇÕES
Composição de Líquidos
As recomendações do USDA e EFSA para a ingestão de água incluem água de outras bebidas e alimentos, já que todas as fontes de água contribuem para a manutenção do balanço hídrico. Estudos mostraram um estado de hidratação semelhante após o consumo de água pura em comparação com o mesmo volume total de líquidos de uma combinação de água e outras bebidas com ou sem cafeína, ou calorias. Por exemplo, o volume de urina 24 horas, a osmolalidade e a cor da urina não diferiram após ingestão de 1,7 L/dia de água pura versus 1,7 L/dia de diversas combinações de água, refrigerantes tipo cola ou tipo cola diet e suco de laranja em homens adultos saudáveis com hábitos livres (Tucker et al., 2015).
Em relação às consequências para a saúde, a maioria dos estudos relatou uma ingestão total de líquidos e não distinguiu claramente a quantidade entre água pura e água proveniente de outras bebidas. Um estudo observacional encontrou uma associação entre ≥ 1 porção de bebida adoçada com açúcar (tipo cola e não-cola) por dia e maior risco de formação de pedra nos rins (Ferraro et al., 2013). Em respeito à saúde renal crônica, uma análise transversal com dados da NHANES encontrou associação entre o consumo de ≥ 2 unidades de bebida não alcoólica adoçada com açúcar/dia e albuminúria (um marcador para DRC). Por outro lado, não houve associação entre ≤ 1 unidades de bebida não alcoólica ou ≥ 2 refrigerantes diet/dia e albuminúria (Shoham et al., 2008). Estudos adicionais são necessários para determinar se efeitos contraditórios devido a fatores da dieta ou do estilo de vida estão presentes. Acredita-se que a frutose em bebidas adoçadas com açúcar possa impactar a saúde renal através do aumento da via frutoquinase e liberação de AVP, mas esta hipótese é baseada em dados experimentais em modelos animais. ECRs são necessários para se estabelecer uma relação causal entre tipos específicos/quantidade de bebidas e as consequências para a saúde do sistema urinário. Em respeito à saúde metabólica, é importante notar que a substituição habitual de bebidas calóricas por água pode contribuir para a perda de peso corporal (Tate et al., 2012). Logo, de maneira conjunta, é evidente que para indivíduos em programas de gerenciamento de peso, ou em risco para doenças cardiometabólicas ou renais, aumentos na ingestão diária de líquidos devem ser provenientes em sua maioria da água pura.
Segurança e Viabilidade
É importante notar os possíveis riscos ou efeitos colaterais da maior ingestão de água. Consumir água ou outros líquidos pobres em sódio em excesso poderia levar à diluição da concentração sanguínea de sódio (hiponatremia). Esta condição é potencialmente perigosa, já que a hiponatremia severa (< 125 mmol/L) pode levar a edema, parada cardiorrespiratória, coma e morte. Especificamente, indivíduos com capacidade renal reduzida de excretar água livre (por exemplo idosos, indivíduos com secreção inadequada de AVP, pacientes em diálise) podem estar em risco para consequências negativas da sobrecarga de líquidos. No entanto, a hiponatremia severa é rara na população em geral, e normalmente ocorre devido à ingestão de líquidos como consequência de cuidados excessivos (IOM, 2005). Além disso, estudos com intervenções relataram diferenças mínimas em eventos adversos, taxas de abandono, ou concentrações séricas de sódio entre grupos que aumentaram a ingestão de água em comparação com nenhuma alteração na ingestão habitual (Clark et al., 2018; Hooton et al., 2018; Nakamura et al., 2020). Isto provavelmente ocorre devido à premissa das recomendações envolvendo a hidratação para a saúde preconizarem o aumento da ingestão de água para os indivíduos que ingerem pouca quantidade de líquidos. Uma maior ingestão habitual de água não é necessária para os indivíduos que já consomem quantidade adequada de líquidos e produzem 2-3 L de urina/dia.
Uma questão comum relatada em estudos com intervenções é a inabilidade de alguns participantes dos estudos em manter o aumento desejado na ingestão diária de água. Situações em que o cumprimento por parte dos indivíduos foi avaliado, a ingestão de água 24 horas (ou produção de urina) no grupo de intervenção foi frequentemente menor que a prescrita (Chung et al., 1999; Clark et al., 2018; Spigt et al., 2012). A razão para a adesão inconsistente não está clara, mas pode estar relacionada a um desejo em declínio, ou viabilidade em manter o aumento da ingestão de água em longo-prazo. Outro inconveniente prático com o maior consumo de água inclui a necessidade frequente de urinar, que pode apresentar um problema caso o indivíduo tenha acesso irregular ou imprevisível a um banheiro limpo (exemplo, ambientes profissionais). De qualquer forma, um cumprimento abaixo do ideal das instruções do estudo em aumentar a ingestão de líquidos, representa uma enorme limitação nos ECRs com o objetivo de determinar os efeitos nas consequências à saúde.
LIMITAÇÕES E DIRECIONAMENTOS FUTUROS
Atualmente, os efeitos da ingestão habitual de líquidos ou do estado de hidratação, são sugestivos de benefícios para algumas doenças crônicas, incluindo a DRC, mas para outras áreas, como as SMet e DCV, o benefício não está tão claro. Algumas das limitações mais comuns incluem o desenho do estudo e a validade e reprodutibilidade das medidas do estado de hidratação. O desenho observacional de estudos compõe a maioria da base de evidências e apresenta as principais limitações. Aqui, as limitações mais importantes são os possíveis efeitos de confusão, onde um fator não medido, ou medido de maneira inadequada, pode falsamente encobrir, ou revelar, uma associação entre a exposição e o resultado. Erros de medidas em estudos observacionais podem influenciar as estimativas do efeito de maneiras imprevisíveis, mas tendem a influenciar as estimativas em direção dos efeitos nulos, ou mais fracos. Além disso, em muitas ocasiões a literatura foi restrita a estudos transversais, onde uma relação temporal não pode ser estabelecida, tornando difícil a interpretação dos resultados. Tais estudos são melhor empregados para o levantamento de hipóteses e devem ser sempre examinados em estudos observacionais prospectivos, ou idealmente ECRs, apesar de muitas consequências de interesse na saúde não funcionarem bem para ECRs (exemplo, período de latência raro e extenso entre a exposição e a doença).
A validade e a reprodutibilidade das medidas também foram limitações grandes para ambos os estudos revisados, observacionais e intervencionais. Definições, termos e biomarcadores utilizados para descrever e medir o estado de hidratação, ou condições de saúde, são inconsistentes na literatura. Outras medidas chaves, tais como padrões gerais de consumo de líquidos ou estimativas da ingestão de líquidos, não foram sempre examinadas ou relatadas. Além disso, muitos estudos revisados foram limitados a populações altamente específicas e podem não ser generalizáveis para outras populações. Sempre que possível, estudos futuros devem empregar ECRs com medidas consistentes, seriadas do estado de hidratação e registros do cumprimento por parte dos indivíduos. Estudos observacionais futuros devem focar em incluir um amplo conjunto de possíveis fatores de confusão e utilizar medidas seriadas e validadas do estado de hidratação.
CONCLUSÃO
Hábitos apropriados de hidratação representam um método simples e barato de possivelmente impactar fatores importantes para a saúde e bem-estar. Para indivíduos em risco, há evidências de que aumentar a ingestão diária de líquidos pode reduzir a recorrência de ITUs e pedras nos rins. Além disso, a ingestão de água pode melhorar de maneira aguda a tolerância ortostática, que pode ser benéfica para indivíduos suscetíveis à síncope após o exercício. Para o gerenciamento do peso, a substituição habitual de bebidas calóricas por água pode contribuir para a perda de peso. Por outro lado, a restrição de líquidos consistentemente prejudica a performance cognitiva e o humor, e pode também ser um fator de risco para dores de cabeça e constipação funcional. No entanto, além das ITUs e pedras nos rins, há poucas evidências de que aumentar a ingestão habitual de líquidos em indivíduos que ingerem pouco líquido possa prevenir ou tratar, as consequências para a saúde. ECRs são necessários para estabelecer relações causais entre a ingestão de líquidos e a DRC, a síndrome metabólica e as doenças cardiovasculares.
APLICAÇÕES PRÁTICAS
- A restrição de líquidos levando à hipohidratação significativa (> 1-2% de deficiência de massa corporal) deve ser evitada já que pode estar associada com a redução do humor (exemplo, sensação de energia, vigor, estado de alerta e habilidade em se concentrar) e da cognição (particularmente na esfera da função executiva), assim como um maior risco para dores de cabeça e constipação funcional.
- Aumentar a ingestão habitual de líquidos pode reduzir o risco para pedras no rim e ITU recorrentes.
- Diretrizes para a ingestão adequada de água não têm a intenção de funcionar para todas as pessoas devido à ingestão diária ideal de líquidos variar entre os indivíduos dependendo da dieta, metabolismo, perda de vapor de água transcutânea, entre outros fatores.
- Ao invés disso, tem sido proposto que a ingestão total de líquidos deve ser suficiente para produzir 2-3 L de urina/dia. Marcadores urinários (≥ 5-7 esvaziamentos da bexiga/dia, < 3-4 na tabela de coloração da urina, ≤ 500 mOsm/kg) podem ser utilizados para monitorar e ajustar a ingestão de líquidos adequadamente.
- Volumes de líquidos adicionais devem ser provenientes em grande parte da água pura, especialmente para aqueles em programas de gerenciamento de peso, ou em risco para doenças cardiometabólicas e renais.
AGRADECIMENTOS
Os autores gostariam de agradecer a Megan Engel e David Keyes pela assistência no desenvolvimento do manuscrito. Os autores são funcionários da PepsiCo R&D. As visões expressas neste artigo são dos autores e não necessariamente refletem a posição ou políticas, da PepsiCo, Inc.
REFERÊNCIAS
Abu-Basha, E.A., S. Yibchok-Anun, and W.H. Hsu (2002). Glucose dependency of arginine vasopressin-induced insulin and glucagon release from the perfused rat pancreas. Metabolism 51:1184-1190.
Anti, M., G. Pignataro, A. Armuzzi, A. Valenti, E. Iascone, R. Marmo, A. Lamazza, A.R. Pretaroli, V. Pace, P. Leo, A. Castelli, and G. Gasbarrini (1998). Water supplementation enhances the effect of high-fiber diet on stool frequency and laxative consumption in adult patients with functional constipation. Hepatogastroenterol. 45:727-732.
Armstrong, L.E., M.S. Ganio, D.J. Casa, E.C. Lee, B.P. McDermott, J.F. Klau, L. Jimenez, L. Le Bellego, E. Chevillotte, and H.R. Lieberman (2012). Mild dehydration affects mood in healthy young women. J. Nutr. 142:382-388.
Arnold, A.C., and C. Shibao (2013). Current concepts in orthostatic hypotension management. Curr. Hypertens. Rep. 15:304-312.
Boilesen, S.N., S. Tahan, F.C. Dias, L. Melli, and M.B. de Morais (2017). Water and fluid intake in the prevention and treatment of functional constipation in children and adolescents: is there evidence? J. Pediatr. 93:320-327.
Borghi, L., T. Meschi, F. Amato, A. Briganti, A. Novarini, and A. Giannini (1996). Urinary volume, water and recurrences in idiopathic calcium nephrolithiasis: a 5-year randomized prospective study. J. Urol. 155:839-843.
Boschmann, M., J. Steiniger, U. Hille, J. Tank, F. Adams, A.M. Sharma, S. Klaus, F.C. Luft, and J. Jordan (2003). Water-induced thermogenesis. J. Clin. Endocrinol. Metab. 88:6015-6019.
Brown, C.M., A.G. Dulloo, and J.P. Montani (2006). Water-induced thermogenesis reconsidered: the effects of osmolality and water temperature on energy expenditure after drinking. J. Clin. Endocrinol. Metab. 91:3598-3602.
Carroll, H.A., I. Templeman, Y.C. Chen, R.M. Edinburgh, E.K. Burch, J.T. Jewitt, G. Povey, T.D. Robinson, W.L. Dooley, R. Jones, K. Tsintzas, W. Gallo, O. Melander, D. Thompson, L.J. James, L. Johnson, and J.A. Betts (2019). Effect of acute hypohydration on glycemic regulation in healthy adults: a randomized crossover trial. J. Appl. Physiol. 126:422-430.
Chan, J., S.F. Knutsen, G.G. Blix, J.W. Lee, and G.E. Fraser (2002). Water, other fluids, and fatal coronary heart disease: the Adventist Health Study. Am. J. Epidemiol. 155:827-833.
Chapman, C.L., B.D. Johnson, M.D. Parker, D. Hostler, R.R. Pryor, and Z. Schlader (2021). Kidney physiology and pathophysiology during heat stress and the modification by exercise, dehydration, heat acclimation and aging. Temperature 8:108-159.
Charrière, N., J.L. Miles-Chan, J.P. Montani, and A.G. Dulloo (2015). Water-induced thermogenesis and fat oxidation: a reassessment. Nutr. Diab. 5:e190.
Chen, L.Y., B.J. Gersh, D.O. Hodge, W. Wieling, S.C. Hammill, and W.K. Shen (2003). Prevalence and clinical outcomes of patients with multiple potential causes of syncope. Mayo Clin. Proc. 78:414-420.
Cheuvront, S.N., and R.W. Kenefick (2016). Am I drinking enough? Yes, mo, and maybe. J. Am. Coll. Nutr. 35:185-192.
Chung, B.D., U. Parekh, and J.H. Sellin (1999). Effect of increased fluid intake on stool output in normal healthy volunteers. J. Clin. Gastroenterol. 28:29-32.
Clark, W.F., J.M. Sontrop, J.J. Macnab, R.S. Suri, L. Moist, M. Salvadori, and A.X. Garg (2011). Urine volume and change in estimated GFR in a community-based cohort study. Clin. J. Am. Soc. Nephrol. 6:2634-2641.
Clark, W.F., J.M. Sontrop, S.H. Huang, K. Gallo, L. Moist, A.A. House, M.S. Cuerden, M.A. Weir, A. Bagga, S. Brimble, A. Burke, N. Muirhead, S. Pandeya, and A.X. Garg (2018). Effect of coaching to increase water intake on kidney function decline in adults with chronic kidney disease: The CKD WIT randomized clinical trial. J. Am. Med. Assoc. 319:1870-1879.
Davis, J.E., and S.M. Fortney (1997). Effect of fluid ingestion on orthostatic responses following acute exercise. Int. J. Sports Med. 18:174-178.
Dennis, E.A., A.L. Dengo, D.L. Comber, K.D. Flack, J. Savla, K.P. Davy, and B.M. Davy (2010). Water consumption increases weight loss during a hypocaloric diet intervention in middle-aged and older adults. Obesity 18:300-307.
Edmonds, C.J., R. Crombie, H. Ballieux, M.R. Gardner, and L. Dawkins (2013a). Water consumption, not expectancies about water consumption, affects cognitive performance in adults. Appetite 60:148-153.
Edmonds, C.J., R. Crombie, and M.R. Gardner (2013b). Subjective thirst moderates changes in speed of responding associated with water consumption. Front. Hum. Neurosci. 7:363.
EFSA. (2010). Scientific opinion on dietary reference values for water. EFSA J. 8:1459-1507.
Eichna, L.W., S.M. Horvath, and W.B. Bean (1947). Post-exertional orthostatic hypotension. Am. J. Med. Sci. 213: 641-654.
El Boustany, R., I. Tasevska, E. Meijer, L.M. Kieneker, S. Enhorning, G. Lefevre, K. Mohammedi, M. Marre, F. Fumeron, B. Balkau, N. Bouby, L. Bankir, S.J. Bakker, R. Roussel, O. Melander, R.T. Gansevoort, and G. Velho (2018). Plasma copeptin and chronic kidney disease risk in 3 European cohorts from the general population. JCI Insight 3:121479.
Enhörning, S., T.J. Wang, P.M. Nilsson, P. Almgren, B. Hedblad, G. Berglund, J. Struck, N.G. Morgenthaler, A. Bergmann, E. Lindholm, L. Groop, V. Lyssenko, M. Orho-Melander, C. Newton-Cheh, and O. Melander (2010). Plasma copeptin and the risk of diabetes mellitus. Circulation 121:2102-2108.
Enhörning, S., L. Bankir, N. Bouby, J. Struck, B. Hedblad, M. Persson, N.G. Morgenthaler, P.M. Nilsson, and O. Melander (2013). Copeptin, a marker of vasopressin, in abdominal obesity, diabetes and microalbuminuria: The prospective Malmö Diet and Cancer Study cardiovascular cohort. Int. J. Obes. 37:598-603.
Ferraro, P.M., E.N. Taylor, G. Gambaro, and G.C. Curhan (2013). Soda and other beverages and the risk of kidney stones. Clin. J. Am. Soc. Nephrol. 8:1389-1395.
Figaro, M.K., and G.W. Mack (1997). Regulation of fluid intake in dehydrated humans: role of oropharyngeal stimulation. Am. J. Physiol. 272:R1740-R1746.
Fink, H.A., J.W. Akornor, P.S. Garimella, R. MacDonald, A. Cutting, I.R. Rutks, M. Monga, and T.J. Wilt (2009). Diet, fluid, or supplements for secondary prevention of nephrolithiasis: a systematic review and meta-analysis of randomized trials. Eur. Urol. 56:72-80.
Halliwill, J.R., D.C. Sieck, S.A. Romero, T.M. Buck, and M.R. Ely (2014). Blood pressure regulation X: what happens when the muscle pump is lost? Post-exercise hypotension and syncope. Eur. J. Appl. Physiol. 114:561-578.
Holtzhausen, L.M., and T.D. Noakes (1995). The prevalence and significance of post-exercise (postural) hypotension in ultramarathon runners. Med. Sci. Sports Exerc. 27:1595-1601.
Hooton, T.M., M. Vecchio, A. Iroz, I. Tack, Q. Dornic, I. Seksek, and Y Lotan (2018). Effect of increased daily water intake in premenopausal women with recurrent urinary tract infections: A randomized clinical trial. J. Am. Med. Assoc. Intern. Med. 178:1509-1515.
Huang, P.L. (2009). A comprehensive definition for metabolic syndrome. Disease models & mechanisms. Dis. Model Mech. 2:231-237.
IOM (2005). Water. In: Dietary Reference Intakes for Water, Potassium, Sodium, Chloride, and Sulfate. National Academies Press, pp.73-185.
Johnson, E.C., C.N. Bardis, L.T. Jansen, J.D. Adams, T.W. Kirkland, and S.A. Kavouras (2017). Reduced water intake deteriorates glucose regulation in patients with type 2 diabetes. Nutr. Res. 43:25-32.
Jordan, J., J.R. Shannon, B.K. Black, Y. Ali, M. Farley, F. Costa, A. Diedrich, R.M. Robertson, I. Biaggioni, and D. Robertson (2000). The pressor response to water drinking in humans : a sympathetic reflex? Circulation 101:504-509.
Kant, A.K., and B.I. Graubard (2017). A prospective study of water intake and subsequent risk of all-cause mortality in a national cohort. Am. J. Clin. Nutr. 105:212-220.
Kant, A.K., and B.I. Graubard (2018). Complementary and compensatory dietary changes associated with consumption or omission of plain water by US adults. Appetite 128:255-262.
Kaufmann, H. (1996). Consensus statement on the definition of orthostatic hypotension, pure autonomic failure and multiple system atrophy. Clin. Auton. Res. 6:125-126.
Kavouras, S.A. (2019). Hydration, dehydration, underhydration, optimal hydration: Are we barking up the wrong tree? Eur. J. Nutr. 58:471-473.
Kavouras, S.A., H.G. Suh, M. Vallet, M. Daudon, A. Mauromoustakos, M. Vecchio, and I. Tack (2021). Urine osmolality predicts calcium-oxalate crystallization risk in patients with recurrent urolithiasis. Urolithiasis 49:399-405.
Keppens, S., and H. de Wulf (1979). The nature of the hepatic receptors involved in vasopressin-induced glycogenolysis. Biochim. Biophys. Acta 588:63-69.
Khorsha, F., A. Mirzababaei, M. Togha, and K. Mirzaei (2020). Association of drinking water and migraine headache severity. J. Clin. Neurosci. 77:81-84.
Klauser, A.G., A. Beck, N.E. Schindlbeck, and S.A. Muller-Lissner (1990). Low fluid intake lowers stool output in healthy male volunteers. Z. Gastroenterol. 28:606-609.
Krediet, C.T.P., A.A.M. Wilde, W. Wieling, and J.R. Halliwill (2004). Exercise related syncope, when it’s not the heart. Clin. Auton. Res. 14:i25-i36.
Lang, F., G.L. Busch, M. Ritter, H. Völkl, S. Waldegger, E. Gulbins, and D. Häussinger (1998). Functional significance of cell volume regulatory mechanisms. Physiol. Rev. 78:247-306.
Lang, F., I. Guelinckx, G. Lemetais, and O. Melander (2017). Two liters a day keep the doctor away? Considerations on the pathophysiology of suboptimal fluid intake in the common population. Kidney Blood Press. Res. 42:483-494.
Linder, B.J., L.J. Rangel, and A.E. Krambeck (2013). The effect of work location on urolithiasis in health care professionals. Urolithiasis 41:327-331.
Mathias, C.J., and J.R. Kimber (1998). Treatment of postural hypotension. J. Neurol. Neurosurg. Psych. 65:285-289.
Nakamura, Y., H. Watanabe, A. Tanaka, M. Yasui, J. Nishihira, and N. Murayama, N. (2020). Effect of increased daily water intake and hydration on health in japanese adults. Nutrients 12:1191.
Nygaard, I., and M. Linder (1997). Thirst at work–an occupational hazard? Int. Urogynecol. J. Pelvic Floor Dysfunct. 8:340-343.
Palmer, S.C., G. Wong, S. Iff, J. Yang, V. Jayaswal, J.C. Craig, E. Rochtchina, P. Mitchell, J.J. Wang, and G.F. Strippoli (2014). Fluid intake and all-cause mortality, cardiovascular mortality and kidney function: a population-based longitudinal cohort study. Nephrol. Dial. Transplant 29:1377-1384.
Pan, X.B., H.J. Wang, B. Zhang, Y.L. Liu, S.F. Qi, and Q.B. Tian (2020). Plain water intake and association with the risk of overweight in the chinese adult population: China Health and Nutrition Survey 2006-2011. J. Epidemiol. 30:128-135.
Pearle, M.S., D.S. Goldfarb, D.G. Assimos, G. Curhan, C.J. Denu-Ciocca, B.R. Matlaga, M. Monga, K. Penniston, G.M. Preminger, T.M. Turk, J.R. White, and American Urological Association (2014). Medical management of kidney stones: AUA guideline. J. Urol. 192:316-324.
Perrier, E.T. (2017). Shifting focus: From hydration for performance to hydration for health. Ann. Nutr. Metab. 70 (Suppl 1):4-12.
Perrier, E., S. Vergne, A. Klein, M. Poupin, P. Rondeau, L. Le Bellego, L.E. Armstrong, F. Lang, J. Stookey, and I. Tack (2013). Hydration biomarkers in free-living adults with different levels of habitual fluid consumption. Br. .J Nutr. 109:1678-1687.
Perrier, E.T., L.E. Armstrong, J.H. Bottin, W.F. Clark, A. Dolci, I. Guelinckx, A. Iroz, S.A. Kavouras, F. Lang, H.R. Lieberman, O. Melander, C. Morin, I. Seksek, J.D. Stookey, I. Tack, T. Vanhaecke, M. Vecchio, and F. Péronnet (2021). Hydration for health hypothesis: a narrative review of supporting evidence. Eur. J. Nutr. 60:1167-1180.
Pross, N., A. Demazieres, N. Girard, R. Barnouin, D. Metzger, A. Klein, E. Perrier, and I. Guelinckx (2014). Effects of changes in water intake on mood of high and low drinkers. PLoS One 9:e94754.
Robertson, G.L. (1984). Abnormalities of thirst regulation. Kidney Int. 25:460-469.
Rogers, P.J., A. Kainth, and H.J. Smit (2001). A drink of water can improve or impair mental performance depending on small differences in thirst. Appetite 36:57-58.
Romero, V., H. Akpinar, and D.G. Assimos (2010). Kidney stones: a global picture of prevalence, incidence, and associated risk factors. Rev. Urol. 12:e86-e96.
Saleem, U., M. Khaleghi, N.G. Morgenthaler, A. Bergmann, J. Struck, T.H. Mosley, and I.J. Kullo (2009). Plasma carboxy-terminal provasopressin (copeptin): a novel marker of insulin resistance and metabolic syndrome. J. Clin. Endocrinol. Metab. 94:2558-2564.
Sawka, M.N., S.N. Cheuvront, and R. Carter (2005). Human water needs. Nutr. Rev. 63:S30-S39.
Schroeder, C., V.E. Bush, L.J. Norcliffe, F.C. Luft, J. Tank, J. Jordan, and R. Hainsworth (2002). Water drinking acutely improves orthostatic tolerance in healthy subjects. Circulation 106:2806-2811.
Scott, E.M., J.P. Greenwood, S.G. Gilbey, J.B. Stoker, and D.A. Mary (2001). Water ingestion increases sympathetic vasoconstrictor discharge in normal human subjects. Clin. Sci. 100:335-342.
Shirreffs, S.M., S.J. Merson, S.M. Fraser, and D.T. Archer (2004). The effects of fluid restriction on hydration status and subjective feelings in man. Br. J. Nutr. 91:951-958.
Shoham, D.A., R. Durazo-Arvizu, H. Kramer, A. Luke, S. Vupputuri, A. Kshirsagar, and R.S. Cooper (2008). Sugary soda consumption and albuminuria: results from the National Health and Nutrition Examination Survey, 1999-2004. PLoS One 3:e3431.
Skolarikos, A., M. Straub, T. Knoll, K. Sarica, C. Seitz, A. Petrik, and C. Turk (2015). Metabolic evaluation and recurrence prevention for urinary stone patients: EAU guidelines. Eur. Urol. 67:750-763.
Spigt, M., N. Weerkamp, J. Troost, C.P. van Schayck, and J.A. Knottnerus (2012). A randomized trial on the effects of regular water intake in patients with recurrent headaches. Fam. Pract. 29:370-375.
Stookey, J.D., S. Kavouras, H. Suh, and F. Lang (2020). Underhydration is associated with obesity, chronic diseases, and death within 3 to 6 years in the U.S. population aged 51-70 years. Nutrients 12:905.
Strippoli, G.F., J.C. Craig, E. Rochtchina, V.M. Flood, J.J. Wang, and P. Mitchell (2011). Fluid and nutrient intake and risk of chronic kidney disease. Nephrology 16:326-334.
Szinnai, G., H. Schachinger, M.J. Arnaud, L. Linder, and U. Keller (2005). Effect of water deprivation on cognitive-motor performance in healthy men and women. Am. J. Physiol. 289:R275-R280.
Tate, D.F., G. Turner-McGrievy, E. Lyons, J. Stevens, K. Erickson, K. Polzien, M. Diamond, X. Wang, and B. Popkin (2012). Replacing caloric beverages with water or diet beverages for weight loss in adults: Main results of the Choose Healthy Options Consciously Everyday (CHOICE) randomized clinical trial. Am. J. Clin. Nutr. 95:555-563.
Then, C., B. Kowall, A. Lechner, C. Meisinger, M. Heier, W. Koenig, A. Peters, W. Rathmann, and J. Seissler (2015). Plasma copeptin is associated with type 2 diabetes in men but not in women in the population-based KORA F4 study. Acta Diabetol. 52:103-112.
Tucker, M.A., M.S. Ganio, J.D. Adams, L.A. Brown, C.B. Ridings, J.M. Burchfield, F.B. Robinson, J.L. McDermott, B.A. Schreiber, N.E. Moyen, T.A. Washington, A.C. Bermudez, M.P. Bennett, and M.E. Buyckx (2015). Hydration status over 24-h is not affected by ingested beverage composition. J. Am. Coll. Nutr. 34:318-327.
Virani, S.S., A. Alonso, E.J. Benjamin, M.S. Bittencourt, C.W. Callaway, A.P. Carson, A.M. Chamberlain, . . . . and C.W. Tsao (2020). Heart disease and stroke statistics – 2020 update: A Report From the American Heart Association. Circulation 141:e139-e596.
Vyas, S., D. Varshney, P. Sharma, R. Juyal, V. Nautiyal, and V. Shrotriya (2015). An overview of the predictors of symptomatic urinary tract infection among nursing students. Ann. Med. Health Sci. Res. 5:54-58.
Watso, J.C., and W.B. Farquhar (2019). Hydration status and cardiovascular function. Nutrients 11:1866.
Weiner, D.E., M.D. McClean, J.S. Kaufman, and D.R. Brooks (2013). The Central American epidemic of CKD. Clin. J. Am. Soc. Nephrol. 8:504-511.
Whitton, P.D., L.M. Rodrigues, and D.A. Hems (1978). Stimulation by vasopressin, angiotensin and oxytocin of gluconeogenesis in hepatocyte suspensions. Biochem. J. 176:893-898.
WHO (2021). Cardiovascular diseases (CVDs).
Wiitbrodt, M., and K. Barnes (2020). Hydration and cognition in the general population. Sports Science Exchange #209.
Wittbrodt, M.T., and M. Millard-Stafford (2018). Dehydration impairs cognitive performance: A meta-analysis. Med. Sci. Sports Exerc. 50:2360-2368.
Xu, C., C. Zhang, X.L. Wang, T.Z. Liu, X.T. Zeng, S. Li, and X.W. Duan (2015). Self-fluid management in prevention of kidney stones: A prisma-compliant systematic review and dose-response meta-analysis of observational studies. Medicine 94:e1042.
Yurtdas, G., N. Acar-Tek, G. Akbulut, O. Cemali, N. Arslan, A. Beyaz Coskun, and F.H. Zengin (2020). Risk factors for constipation in adults: A cross-sectional study. J. Am. Coll. Nutr. 39:713-719.
Ziegenhagen, D.J., G. Tewinkel, W. Kruis, and F. Herrmann (1991). Adding more fluid to wheat bran has no significant effects on intestinal functions of healthy subjects. J. Clin. Gastroenterol. 13:525-530.






