SSE #238: CONSIDERAÇÕES SOBRE MICRONUTRIENTES PARA ATLETAS DO SEXO FEMININO
Publicado em
June 2023
Autor
Alannah KA McKay PhD, Marc Sim PhD e Peter Peeling PhD
PONTOS-CHAVE:
- As mulheres podem apresentar um risco maior para deficiências de certos micronutrientes (particularmente o ferro, cálcio, a vitamina D e o folato). Enquanto uma abordagem considerando “primeiro os alimentos” deve ser considerada, em alguns momentos, a suplementação pode ser necessária.
- A ingestão energética geral é frequentemente mais baixa em atletas do sexo feminino, em comparação com atletas do sexo masculino, e isso pode dificultar atingir a ingestão diária recomendada (IDR) para os micronutrientes. Estados de baixa disponibilidade de energia podem tornar a situação ainda mais desafiadora.
- O estado e a regulação de ferro em atletas do sexo feminino podem ser influenciados por flutuações nos hormônios ovarianos e pela perda de sangue na menstruação. Logo, a IDR para o ferro é 2,5 vezes maior em mulheres em comparação com os homens.
- A ingestão adequada de cálcio e níveis adequados de vitamina D circulante são importantes para manter a saúde óssea. Na presença de um baixo nível de estrógeno (como na amenorreia), estes micronutrientes são progressivamente mais importantes para limitar o risco de fraturas por estresse.
- O folato tem um papel na produção de novas células vermelhas do sangue e, portanto, a suplementação deve ser considerada por atletas do sexo feminino que planejam engravidar.
INTRODUÇÃO
Vitaminas e minerais são essenciais para inúmeros processos metabólicos no corpo, sendo fundamentais como suporte à saúde e à performance do atleta. Especificamente, os micronutrientes estão envolvidos em processos como o funcionamento imunológico, a adaptação hematológica, o metabolismo de energia e o crescimento e a reparação muscular, e pequenas deficiências podem levar a grandes distúrbios metabólicos. Atletas frequentemente apresentam maiores necessidades de micronutrientes do que a população em geral devido a uma maior utilização e/ou maiores perdas de micronutrientes associadas ao exercício e às adaptações aos treinos. Por esta razão, atletas podem apresentam um risco maior para deficiências, já que suas necessidades gerais normalmente ultrapassam as quantidades da ingestão diária recomendada (IDR). Em nota, a alimentação é o meio principal (e preferível) para o corpo obter diversas vitaminas e minerais. No entanto, quando as necessidades são altas, os suplementos podem ser utilizados para auxiliar a manutenção das concentrações de vitaminas e minerais dentro de um intervalo adequado. Devido a inúmeros fatores, as mulheres podem apresentar um risco maior para deficiências de certos micronutrientes (McClung et al., 2014) e, portanto, suas necessidades nutricionais precisam de consideração adicional. O propósito deste artigo do Sports Science Exchange é revisar as necessidades nutricionais das atletas do sexo feminino, considerando especificamente a otimização da ingestão e o estado de micronutrientes nessa população.
O QUE FAZ DAS MULHERES SERES ÚNICOS?
Há atributos biológicos e fenotípicos essenciais que tornam as mulheres diferentes dos homens. Os homens têm proporcionalmente maior massa muscular e óssea, enquanto as mulheres exibem maior massa de gordura e menor volume sanguíneo (e, consequentemente, menor massa de hemoglobina) (Blair, 2007). Estas características podem resultar em diferenças no débito cardíaco, na capacidade aeróbica, regulação térmica e na produção de força muscular entre os sexos. Outra diferença fundamental é a presença de diferentes hormônios esteroides associados à reprodução. Nos homens, a testosterona é o principal hormônio circulante, que apresenta ambos os papéis; reprodutivo e anabólico (Hackney, 1989); nas mulheres, os principais hormônios são o estrógeno e a progesterona (Owen, 1975). As concentrações de ambos, estrógeno e progesterona, mudam de maneira cíclica ao longo do ciclo menstrual, assim como cronicamente ao longo do curso de vida (da puberdade à menopausa). Outros fatores que podem causar alterações nas concentrações dos hormônios ovarianos incluem o uso de contraceptivo hormonal, a gravidez, e/ou desequilíbrios na dieta/exercício. De maneira conjunta, essas diferenças morfológicas e hormonais entre os sexos tornam as mulheres únicas e, portanto, as necessidades de micronutrientes precisam considerar tais diferenças.
CONSIDERAÇÕES NUTRICIONAIS ATLETAS DO SEXO FEMININO
Atualmente, há evidências insuficientes para se fornecer uma orientação nutricional generalizada para atletas mulheres, para customizar suas necessidades ao estado ou ao ciclo menstrual, principalmente devido à falta de pesquisas de qualidade para respaldar quaisquer dessas recomendações (Holtzman & Ackerman, 2021). Por exemplo, se focarmos em apenas um macronutriente, o carboidrato (CHO), as revisões recentes encontraram que apenas 11% dos participantes em estudos examinando as estratégias energéticas agudas (Kuikman et al., 2023) e 16% dos participantes em estudos examinando estratégias energéticas crônicas (Kuikman et al., In Press) eram do sexo feminino. Além disso, das pesquisas existentes com mulheres, apenas 6,6% e 0,8% dos estudos que examinaram as estratégias energéticas agudas e crônicas, respectivamente, utilizaram um controle metodológico adequado dos perfis de hormônios ovarianos (Kuikman et al., 2023; In Press). Logo, devido à escassez atual de dados examinando as necessidades mais gerais de nutrientes das atletas do sexo feminino, é quase impossível fornecer empiricamente uma orientação direcionada específica ao estado menstrual ou para durante o ciclo menstrual.
A tentativa mais prática para representar mulheres nas diretrizes atuais de nutrição esportiva foi para dimensionar a ingestão de energia e macronutrientes em relação ao tamanho corporal (ao invés de quantidades absolutas), em reconhecimento ao frequentemente menor tamanho corporal das mulheres. Logo, as necessidades de ingestão de energia, em valores absolutos, das atletas do sexo feminino são com frequência menores que as dos homens, e comumente isso está associado com uma menor ingestão de micronutrientes. Isso é contraintuitivo, já que as IDRs de alguns micronutrientes são iguais, ou maiores para as mulheres em comparação aos homens. Por exemplo, uma típica dieta ocidental forneceu aproximadamente 6 mg de ferro proveniente da dieta por 1.000 kcal de energia (Thomas et al., 2016). Para um homem atingir o valor da sua ingestão diária recomendada para o ferro (8 mg/dia), apenas 1.330 kcal seriam suficientes, em comparação com as mulheres que precisariam consumir 3.000 kcal para conseguir atingir o valor da sua ingestão diária recomendada (18 mg/dia); isso resulta em uma ingestão calórica 56% maior! Desta forma, consumir uma ingestão adequada de micronutrientes da dieta pode ser mais desafiador para as mulheres devido à dicotomia da necessidade de maiores quantidades de micronutrientes a partir de uma menor ingestão de energia. Para compor este problema, as mulheres podem apresentar uma probabilidade maior em aderir a dietas especiais, que podem ser restritivas em relação à ingestão de micronutrientes. Por exemplo, dietas vegetarianas ou veganas possuem menor quantidade de fontes de ferro heme, conhecidas por terem uma maior capacidade de absorção. Além disso, atletas do sexo feminino que restringem os laticínios (dietas livre de lactose) estão em maior risco de ingestão inadequada de cálcio, o que é problemático devido a sua maior necessidade de cálcio em comparação aos homens.
Outro cenário que pode levar a uma disponibilidade inadequada de micronutrientes é quando as atletas estão em um estado de baixa disponibilidade de energia (BDE). Essencialmente, as atletas são solicitadas a consumir calorias suficientes para atingir suas necessidades diárias de energia e manter um funcionamento fisiológico normal. A baixa disponibilidade de energia ocorre quando há uma discrepância entre a ingestão de energia e o gasto de energia. Uma BDE prolongada pode levar ao desenvolvimento da Tríade da Mulher e do Homem Atleta (Nattiv et al., 2021) e/ou Deficiência Relativa de Energia no Esporte (RED-S) (Mountjoy et al., 2018), quando se nota efeitos negativos significativos na saúde e performance. Há algumas evidências para sugerir que a BDE e suas condições associadas são mais prevalentes em mulheres, quando comparadas aos homens (Jesus et al., 2021), no entanto, isso pode ser resultado de um reconhecimento relativamente recente destas condições em populações masculinas (Mountjoy et al., 2014; Nattiv et al., 2021); somado às dificuldades associadas com o processo de definir e mensurar a BDE em coortes atléticas (Burke et al., 2018). Curiosamente, a RED-S e a Tríade do Atleta, especificamente, podem não ser favoráveis para as mulheres. Por exemplo, um estudo anterior mostrou que a saúde óssea pode ser impactada negativamente por uma curta exposição à BDE (5 dias com 15 kcal/kg de massa livre de gordura em mulheres, mas não em homens) (Papageorgiou et al., 2017)). Isso pode implicar no fato de que os homens são mais robustos em relação a alguns dos efeitos derivados da BDE, permitindo a eles uma exposição mais severa a BDE, antes que danos fisiológicos possam ser vistos (De Souza et al., 2019).
Não apenas as dietas com BDE estão associadas com uma menor ingestão de micronutrientes (McKay et al., 2022), mas há evidências para sugerir que a BDE pode afetar negativamente a regulação e a absorção de alguns micronutrientes. De fato, a BDE foi pensada estar associada com aumentos no hormônio regulador de ferro, a hepcidina (McKay et al., 2020), limitando a quantidade de ferro alimentar que pode ser absorvido da dieta, possivelmente levando a um estado ruim de ferro ao longo do tempo. Atualmente, a interação entre a BDE e os micronutrientes não é bem compreendida e é provavelmente mediada por outros fatores impactados pela BDE, como as concentrações de hormônios ovarianos, restrições de macronutrientes e/ou maiores cargas de treinos. O que é aparente é que em ambos os casos, com ou sem presença de BDE, as atletas do sexo feminino podem estar em maior risco para deficiências de micronutrientes. De fato, foi relatado que a deficiência de ferro é aproximadamente 3 vezes mais comum em atletas mulheres (15-35%), em comparação com atletas homens (3-11%) (Sim et al., 2019). Adicionalmente, uma saúde óssea ruim é altamente prevalente em atletas do sexo feminino (Chen et al., 2013), tornando a ingestão adequada de cálcio e vitamina D cada vez mais importante para essa coorte. Especificamente, estima-se que as fraturas por estresse sejam vivenciadas por 9,7% das atletas do sexo feminino, em comparação com 6,5% de seus pares do sexo masculino (Chen et al., 2013). Portanto, é importante se entender as necessidades de micronutrientes do atleta e considerar se isso pode ser atingido por meio da otimização alimentar, ou se a suplementação é necessária. As seguintes seções revisam as recomendações para quatro micronutrientes essenciais (Figura 1), e as implicações para a atleta do sexo feminino.
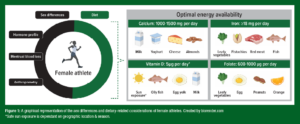
Figura 1: uma representação gráfica das diferenças entre os sexos e as considerações relacionadas à dieta das atletas do sexo feminino. Criado por biorender.com
*A exposição segura ao sol depende da localização geográfica e estação do ano.
Tradução da figura:
Diferenças entre os sexos/ Dieta
Perfil hormonal / Perda de sangue da menstruação/ Antropometria
Disponibilidade ótima de energia
Cálcio: 1000-1500 mg por dia/ leite/ iogurte/ queijo/ amêndoas
Ferro: ≥ 18 mg por dia/ hortaliças folhosas/ pistache/ carne vermelha/ peixe
Vitamina D: 5 mcg por dia / exposição solar/ peixes gordurosos/ gema do ovo/ leite
Folato: 600-1000 mcg por dia/ hortaliças folhosas/ ovos/ amendoim/ laranja
FERRO
O ferro é um micronutriente essencial com inúmeros papéis no corpo, incluindo o transporte de oxigênio e o metabolismo de energia. Os atletas são considerados apresentar um maior risco para deficiência de ferro devido às maiores vias de perda de ferro (transpiração, hemólise, sangramento gastrointestinal) e uma absorção reduzida de ferro (aumentos transitórios nas concentrações de hepcidina) que pode ser resultado do exercício (Peeling et al., 2008). Desta forma, estima-se que uma quantidade adicional de 1-2 mg de ferro por dia para repor as perdas de ferro relacionadas ao exercício (Nielsen & Nachtigall, 1998) e que um valor de IDR maior para as populações atléticas provavelmente seja necessário. Quando as perdas não são adequadamente repostas, a deficiência de ferro, com ou sem anemia, pode aparecer. Quando o quadro não é tratado, a produção alterada de células vermelhas do sangue pode prejudicar tanto a saúde quanto a performance.
Atletas do sexo feminino enfrentam desafios extras quando se trata de manter os estoques de ferro saudáveis. Primeiramente, o ferro perdido durante a menstruação pode ser um fator significativo ao se considerar o balanço de ferro nas mulheres, com estimativas sugerindo que uma quantidade entre 5-40 mg de ferro é perdida em cada ciclo (Harvey et al., 2005). Além disso, um fluxo menstrual pesado (FMP) é uma condição menstrual que se acredita ser altamente prevalente em coortes de atletas do sexo feminino (Bruinvels et al., 2016), resultando em maiores perdas de ferro e aumentando a susceptibilidade de uma atleta à deficiência de ferro. Em nota, a utilização de pílulas contraceptivas orais pode auxiliar no gerenciamento do FMP e, consequentemente, no gerenciamento da deficiência de ferro. Contudo, tais abordagens devem apenas ser utilizadas após consultar um médico esportivo experiente.
Outra diferença entre os sexos está relacionada com o impacto dos hormônios esteroides no hormônio que regula o ferro, a hepcidina. O estrógeno foi mostrado ter efeitos inibitórios na hepcidina (Yang et al., 2012), o que significa que a absorção de ferro pode ser maior nos momentos em que o estrógeno está elevado (fases 2 e 4 do ciclo menstrual) (Elliott- Sale et al., 2021). Desta forma, uma ingestão de ferro com foco nessas fases pode fornecer uma oportunidade para se recuperar na perda líquida de ferro que ocorre com a menstruação. Contudo, enquanto um respaldo do mecanismo para essa associação é forte, estudos em ensaios com seres humanos não são claros (Alfaro-Magallanes et al., 2022; Barba-Moreno et al., 2022) e, portanto, pesquisas são necessárias para explorar essa ideia. Em homens, acredita-se que a testosterona tenha efeitos semelhantes ao estrógeno ao inibir os níveis de hepcidina (Hennigar et al., 2020). No entanto, com as concentrações de testosterona permanecendo relativamente estáveis no dia a dia, é provável que a capacidade geral em absorver o ferro seja maior em homens em comparação às mulheres. De maneira conjunta, estes fatores justificam as maiores taxas de deficiência de ferro observadas em mulheres em comparação com os atletas homens (15-35% comparado a 3-11%) (Sim et al., 2019). As maiores perdas de ferro observadas em mulheres também são refletidas na IDR para o ferro, que sugere que as mulheres necessitem de 18 mg de ferro por dia, em comparação com apenas 8 mg de ferro por dia para os homens. Contudo, estas recomendações foram criadas para a população em geral, e muito provavelmente são muito mais altas nas populações atléticas. Devido a essa disparidade, atletas do sexo feminino devem ser avaliadas para deficiência de ferro em intervalos de 6 meses, e mais frequentemente (trimestralmente) em casos de comprometimentos conhecidos em relação ao ferro, BDE, adoção de dietas especiais e/ou distúrbios menstruais (como a amenorreia). Para informações adicionais, consulte o artigo #239 do Sport Science Exchange, que resume as demandas específicas de ferro para atletas.
CÁLCIO
Em relação aos ossos, tanto o cálcio quanto a vitamina D têm sido investigados em atletas com certa frequência, no contexto da prevenção de lesões (fratura por estresse). Especificamente ao cálcio, a população em geral de homens e mulheres abaixo de 50 anos de idade apresentam IDRs semelhantes, de 1000 mg/dia. Essa quantidade aumenta para 1300 mg/dia para as mulheres pós-menopausa (50 anos de idade, ou mais) devido aos níveis mais baixos de estrógeno; um hormônio que ajuda a aumentar a absorção e a retenção de cálcio nos ossos (Australian Government Department of Health, 2021). Para os atletas, uma IDR de 1500 mg/dia foi sugerida pelo Comitê Olímpico Internacional (COI) para atingir as maiores demandas metabólicas para auxiliar a saúde óssea (Mountjoy et al., 2014). Idealmente, essa quantidade deve ser fracionada ao longo do dia (em porções <500 mg) para maximizar a absorção (Harvey et al., 1988). É digno de nota, que a ingestão adicional de cálcio é especialmente relevante para as atletas amenorreicas para maximizar a oportunidade de absorção, na presença de níveis baixos de estrógeno. De maneira não surpreendente, as atletas amenorreicas são até quatro vezes mais propensas de sofrer fraturas por estresse em comparação com as atletas que menstruam (Heikura et al., 2018).
Ao se considerar as populações atléticas, o exercício intenso prolongado também pode levar a maiores perdas de cálcio através do suor. Somado a uma baixa ingestão alimentar de cálcio, pode haver redução dos níveis circulantes de cálcio. Como resposta, o corpo vai procurar aumentar os níveis de cálcio circulantes pela quebra óssea (por meio de células específicas chamadas de osteoclastos), como gatilho da estimulação do hormônio paratireoidiano (PTH). Com o tempo, isso pode comprometer a integridade do osso e em última instância predispor o indivíduo à osteoporose e fraturas (Rowe et al., 2022). Tais eventos podem ser especialmente relevantes para as atletas mulheres que apresentam RED-S. Considerando-se mulheres adolescentes, o pico de massa óssea é frequentemente adquirido até 20 anos de idade (algumas aumentam até 30 anos de idade) (Tan et al. In Press). Consequentemente, a exposição a longo prazo a BDE, especialmente durante a adolescência, pode ter consequências severas em longo-prazo para os ossos. Especificamente, o início precoce da osteoporose (normalmente com 50 anos ou menos) predispõe um indivíduo a fraturas por fragilidade para o resto de suas vidas (Mäkitie & Zillikens, 2022).
Os atletas podem atingir suas necessidades de cálcio por meio de diversas porções de laticínios (leite, queijos, iogurtes) ou inúmeras porções diárias de fontes vegetais (exemplo, hortaliças verdes folhosas, brócolis, soja, leite vegetal fortificado). O leite de vaca tem alta biodisponibilidade de cálcio com uma taxa fracionada de absorção de 32% (Weaver et al., 1999), mas muitos alimentos vegetais apresentam taxas de absorção semelhantes ou melhores (Lombardi et al., 2013). Notavelmente, o iogurte, o leite de vaca, o tofu e a acelga chinesa (Bok Choy) representam boas fontes de cálcio, com algumas das taxas mais altas de absorção. Nos momentos em que a ingestão adequada de cálcio não pode ser atingida a partir da alimentação isoladamente, suplementos de cálcio (totalizando 1.000-1.500 mg/dia) podem ser considerados sob supervisão de profissionais da saúde capacitados. Finalmente, as atletas devem estar cientes das possíveis interações entre os suplementos de cálcio e outros medicamentos (ou suplementos) devido a certas combinações gerarem efeitos negativos. Por exemplo, tomar suplementos de cálcio e ferro ao mesmo tempo, pode reduzir a absorção de ambos os minerais. Além disso, os suplementos de cálcio podem interferir com certas medicações como antibióticos, bisfosfonatos (para prevenir a perda óssea) e terapia de reposição dos hormônios da tireoide, comprometendo assim a eficácia da medicação.
VITAMINA D
A vitamina D é um micronutriente crucial que contribui para muitos processos fisiológicos relevantes aos atletas, incluindo a remodelação da musculatura esquelética, a função muscular, a imunidade, a estrutura e a função cardíaca, e a saúde óssea. Uma estimativa de 33-42% das atletas apresentam insuficiência de vitamina D, sendo o tipo de atleta, a estação do ano e a localização geográfica, todos fatores contribuintes (Ogan & Pritchett, 2013). A Fundação Internacional de Osteoporose sugere que os níveis circulantes de vitamina D (25-hidroxivitamina D, 25(OH)D) entre 25-49 nmol/L indicam deficiência e que 75-110 nmol/L representam adequação (International Osteoporosis Foundation, 2022). No entanto, ainda há um grande debate sobre o que isso representa para atletas, embora normalmente uma 25(OH)D abaixo de 25 nmol/L definir uma deficiência (Owens et al., 2018). Até o momento, não se chegou a um consenso sobre os limites para uma insuficiência ou sobre os níveis ideais para atletas. Uma exposição ao sol (altamente dependente da localização geográfica/estação do ano) e ingestão alimentar (a vitamina D é encontrada em peixes gordurosos, gema do ovo e leite fortificado) adequadas são importantes para otimizar os níveis de 25(OH)D. Contudo, onde inadequações ainda são evidentes, a suplementação com 2000-4000 UI de vitamina D3/dia pode ser benéfica (Owens et al., 2018). Especificamente em relação às mulheres, a vitamina D também tem um papel fundamental na produção de estrógeno (Kinuta et al., 2000) e, portanto, os efeitos da deficiência de vitamina D podem ter longo alcance, afetando a saúde óssea, o estado menstrual e a fertilidade (Shahrokhi et al., 2016).
Um dos papéis essenciais da vitamina D é otimizar a absorção de cálcio e a mineralização óssea. Assim, é provável que os atletas que sejam deficientes de vitamina D apresentem um risco maior para fraturas por estresse (Millward et al., 2020). Em especial, em um estudo onde os atletas apresentaram níveis de 25(OH)D ≥ 75 nmol/L, aproximadamente 30% do cálcio dietético foi absorvido em comparação com apenas 10-15% quando a 25(OH)D foi < 50 nmol/L (Larson- Meyer, 2015). A relação próxima entre o cálcio e a vitamina D é bem estabelecida e evidente pelo fato de os suplementos de cálcio mais comerciais também conterem vitamina D (colecalciferol). Com a presença de fraturas por estresse e uma saúde óssea ruim sendo particularmente aparente em atletas mulheres (Chen et al., 2013), é importante garantir uma ingestão suficiente de ambos, cálcio e vitamina D, na qual um suplemento combinado pode ser uma opção conveniente, onde deficiências coexistentes sejam aparentes.
FOLATO
O folato é outra vitamina importante para atletas do sexo feminino. O folato é uma vitamina do complexo B que tem papéis importantes na produção de novas células vermelhas do sangue, com a deficiência de folato provavelmente resultando em anemia e estando associada à redução da performance. Alimentos como legumes, hortaliças folhosas verde escuras, laranjas e ovos são naturalmente altos em folato, e em muitos países, ingredientes comuns como a farinha de trigo e os cereais matinais são fortificados com folato sintético (ácido fólico). Um cenário onde a deficiência de folato é comum em mulheres é durante a gravidez, onde as demandas de folato associadas ao crescimento e desenvolvimento fetal são estimadas ser aproximadamente duas vezes maiores (McPartlin et al., 1993). Esse é especificamente o caso quando uma atleta continua treinando ao longo da gravidez, já que o estresse hematológico extra resultante dos grandes volumes de exercício pode acelerar a progressão da deficiência. A IDR como suporte para a saúde reprodutiva e crescimento fetal é de 600 mcg de folato dietético equivalente (DFE) de ácido fólico, um mês antes e durante a gravidez (Australian Government Department of Health, 2021). Contudo, essas recomendações visam a população geral ao invés de atletas, e as necessidades de folato para atletas no pré-natal e gestantes ainda não foram estabelecidas. Porém, devido à maioria dos suplementos de vitaminas pré-natais conterem entre 800-1000 mcg de DFE de ácido fólico, essa quantidade deve ser adequada para as atletas com uma provável deficiência pré-existente não evidente. No entanto, dada a falta de pesquisas nesta área, uma consulta e avaliação individualizada para checar possíveis deficiências de nutrientes ao longo da gravidez são altamente recomendadas. Finalmente, há estudos mostrando que a utilização de contraceptivos orais está associada com concentrações reduzidas de folato plasmático e folato nas células vermelhas do sangue (Shere et al., 2015) e, portanto, as atletas que utilizam contracepção oral podem procurar aumentar o consumo de folato, particularmente se estejam planejando engravidar.
APLICAÇÕES PRÁTICAS
- Atletas do sexo feminino devem trabalhar em conjunto com seus médicos esportivos para incluir alimentos integrais de alta densidade nutricional nas suas necessidades diárias de energia.
- Os suplementos podem ser úteis, seja para corrigir a deficiência (como, a deficiência de ferro) ou garantir uma ingestão adequada para manter os processos fisiológicos (como a saúde óssea, a adaptação hematológica). Isso pode ser de maior importância para atletas mulheres que apresentam maiores perdas e/ou necessidades de micronutrientes.
- Nesta fase, nenhuma diretriz nutricional generalizada pode ser fornecida às atletas do sexo feminino com base em seu estado e/ou fase menstrual. Entender como o ciclo menstrual e a utilização de contraceptivos hormonais impactam na regulação do nutriente, pode auxiliar no desenvolvimento de estratégias individualizadas para minimizar deficiências de micronutrientes.
RESUMO
Atletas do sexo feminino podem apresentar um maior risco para deficiências de micronutrientes. Garantir uma ingestão adequada de energia e uma dieta rica em nutrientes é importante para uma abordagem inicial considerando “primeiro os alimentos” para manter a ingestão adequada de micronutrientes. No entanto, em certas ocasiões, as atletas podem querer considerar um suplemento de vitamina ou mineral para atingir suas necessidades diárias de micronutrientes. O ferro, o cálcio, a vitamina D e o folato são identificados como micronutrientes que requerem maior atenção para atletas do sexo feminino. Ao se considerar uma suplementação de ferro, cálcio e vitamina D, as mulheres são bem representadas na literatura (71%), provavelmente devido às maiores taxas de deficiências evidentes em mulheres (Smith et al., 2022). Contudo, um melhor entendimento do estado menstrual, especialmente em populações atléticas de elite, ainda é necessário (Smith et al., 2022). Finalmente, é importante notar que para todos os micronutrientes, a suplementação não fornecerá um efeito ergogênico e não deve ser utilizada para melhorar a performance, pelo contrário, estes suplementos devem apenas serem utilizados para corrigir deficiências. De fato, muitos destes micronutrientes são tóxicos em altas dosagens e, portanto, a decisão de suplementar deve ser tomada em consulta com nutricionistas esportivos experientes.
Os pontos de vista expressos aqui são dos autores e não refletem necessariamente a posição, ou política, da PepsiCo, Inc.
REFERÊNCIAS
Alfaro-Magallanes, V.M., L. Barba-Moreno, N. Romero-Parra, B. Rael, P.J. Benito, D.W. Swinkels, C.M. Laarakkers, A.E. Diaz, A.B. Peinado, and F.S.G. Iron (2022). Menstrual cycle following interval running exercise in endurance- affects iron homeostasis and hepcidin trained women. Eur. J. Appl. Physiol. 122:2683-2694.
Australian Government Department of Health (2021). Nutrient reference values for Australia and New Zealand – Calcium. Eat for Health. Retrieved March 21st 2023, from https:// www.eatforhealth.gov.au/nutrient-reference-values
Barba-Moreno, L., V.M. Alfaro-Magallanes, X. de Jonge, A.E. Diaz, R. Cupeiro, and A.B. Peinado (2022). Hepcidin and interleukin-6 responses to endurance exercise over the menstrual cycle. Eur. J. Sport Sci. 22:218-226.
Blair, M.L. (2007). Sex-based differences in physiology: what should we teach in the medical curriculum? Adv. Physiol. Educ. 31:23-25.
Bruinvels, G., R. Burden, N. Brown, T. Richards, and C. Pedlar (2016). The prevalence and impact of heavy menstrual bleeding among athletes and mass start runners of the 2015 London Marathon. Br. J. Sports Med. 50:566-566.
Burke, L.M., B. Lundy, I.L. Fahrenholtz, and A.K. Melin (2018). Pitfalls of conducting and interpreting estimates of energy availability in free-living athletes. Int. J. Sport Nutr. Exerc. Metab. 28:350-363.
Chen, Y.T., A.S. Tenforde, and M. Fredericson (2013). Update on stress fractures in female athletes: epidemiology, treatment, and prevention. Curr. Rev. Musculoskelet. Med. 6:173-181.
De Souza, M.J., K.J. Koltun, and N.I. Williams (2019). The role of energy availability in reproductive function in the female athlete triad and extension of its effects to men: an initial working model of a similar syndrome in male athletes. Sports Med. 49(Suppl 2):125-137.
Elliott-Sale, K.J., C.L. Minahan, X.A.J. de Jonge, K.E. Ackerman, S. Sipilä, N.W. Constantini, C.M. Lebrun, and A.C. Hackney (2021). Methodological considerations for studies in sport and exercise science with women as participants: a working guide for standards of practice for research on women. Sports Med. 51:843-861.
Hackney, A.C. (1989). Endurance training and testosterone levels. Sports Med. 8:117-127.
Harvey, J.A., M.M. Zobitz, and C.Y. Pak (1988). Dose dependency of calcium absorption: a comparison of calcium carbonate and calcium citrate. J. Bone Miner. Res. 3:253–258.
Harvey, L.J., C.N. Armah, J.R. Dainty, R.J. Foxall, D.J. Lewis, N.J. Langford, and S.J. Fairweather-Tait (2005). Impact of menstrual blood loss and diet on iron deficiency among women in the UK. Br. J. Nutr. 94:557-564.
Heikura, I.A., A.L. Uusitalo, T. Stellingwerff, D. Bergland, A.A. Mero, and L.M. Burke (2018). Low energy availability is difficult to assess but outcomes have large impact on bone injury rates in elite distance athletes Int. J. Sport Nutr. Exerc. Metab. 28:403-411.
Hennigar, S.R., C.E. Berryman, M.N. Harris, J.P. Karl, H.R. Lieberman, J.P. McClung, J.C. Rood, and S.M. Pasiakos (2020). Testosterone administration during energy deficit suppresses hepcidin and increases iron availability for erythropoiesis. J. Clin. Endocrinol. Metab. 105:dgz316.
Holtzman, B., and K.E. Ackerman (2021). Recommendations and nutritional considerations for female athletes: Health and performance. Sports Med. 51:43-57.
International Osteoporosis Foundation. (2022). Vitamin D. Prevention. Retrieved March 30th 2023, from https://www.osteoporosis.foundation/health-professionals/prevention/ nutrition/vitamin-d
Jesus, F., I. Castela, A.M. Silva, P.A. Branco, and M. Sousa (2021). Risk of low energy availability among female and male elite runners competing at the 26th European cross-country championships. Nutrients 13:873.
Kinuta, K., H. Tanaka, T. Moriwake, K. Aya, S. Kato, and Y. Seino (2000). Vitamin D is an important factor in estrogen biosynthesis of both female and male gonads. Endocrinology 141:1317-1324.
Kuikman, M., E.S. Smith, A.K.A. McKay, K.E. Ackerman, R. Harris, K.J. Elliott-Sale, T. Stellingwerff, and L.M. Burke (2023). Fuelling the female athlete: auditing her representation in studies of acute carbohydrate intake for exercise. Med. Sci. Sports Exerc. 55:569-580.
Kuikman, M.A., A.K.A. McKay, E.S. Smith, K.E. Ackerman, R. Harris, K.J. Elliott-Sale, T. Stellingwerff, and L.M. Burke (In Press). Female athlete representation and dietary control methods among studies assessing chronic carbohydrate approaches to support training. Int. J. Sport Nutr. Exerc. Metab. In Press.
Larson-Meyer, D. (2015). The importance of vitamin D for athletes. Sports Sci. Exch. 28:1-8.
Lombardi, G., G. Lippi, and G. Banfi (2013). Iron requirements and iron status of athletes. The Encyclopaedia of Sports Medicine: an IOC Medical Commission publication, 19:229- 241.
Mäkitie, O., and M.C. Zillikens (2022). Early-onset osteoporosis. Calcif. Tissue Int. 110:546- 561.
McClung, J.P., E. Gaffnew-Stomberg, and J.J. Lee (2014). Female athletes: A population at risk of vitamin and mineral deficiencies affecting health and performance. J. Trace Elem. Med. Biol. 28:388-392.
McKay, A.K.A., D.B. Pyne, L.M. Burke, and P. Peeling (2020). Iron metabolism: interactions with energy and carbohydrate availability. Nutrients 12:3692.
McKay, A.K., P. Peeling, D.B. Pyne, N. Tee, J. Whitfield, A.P. Sharma, I.A. Heikura, and L.M. Burke (2022). Six days of low carbohydrate, not energy availability, alters the iron and immune response to exercise in elite athletes. Med. Sci. Sports Exerc. 54:337-387.
McPartlin, J., A. Halligan, J.M. Scott, M. Darling, and D.G. Weir (1993). Accelerated folate breakdown in pregnancy. Lancet 341:148-149.
Millward, D., A.D. Root, J. Dubois, R.P. Cohen, L. Valdivia, B. Helming, J. Kokoskie, A.L. Waterbrook, and S. Paul (2020). Association of serum vitamin D levels and stress fractures in collegiate athletes. Orthop. J. Sports Med. 8:2325967120966967.
Mountjoy, M., J. Sundgot-Borgen, L. Burke, S. Carter, N. Constantini, C. Lebrun, N. Meyer, R. Sherman, K. Steffen, and R. Budgett (2014). The IOC consensus statement: beyond the female athlete triad—Relative Energy Deficiency in Sport (RED-S). Br. J. Sports Med. 48:491-497.
Mountjoy, M., J. Sundgot-Borgen, L. Burke, K.E. Ackerman, C. Blauwet, N. Constantini, C. Lebrun, B. Lundy, A. Melin, and N. Meyer (2018). International Olympic Committee (IOC) consensus statement on Relative Energy Deficiency in Sport (RED-S): 2018 Update. Int. J. Sport Nutr. Exerc. Metab. 28:316-331.
Nattiv, A., M.J. De Souza, K.J. Koltun, M. Misra, A. Kussman, N.I. Williams, M.T. Barrack, E. Kraus, E. Joy, and M. Fredericson (2021). The male athlete triad—a consensus statement from the Female and Male Athlete Triad Coalition Part 1: Definition and scientific basis. Clin. J. Sport Med. 31:335-348.
Nielsen, P., and D. Nachtigall (1998). Iron supplementation in athletes. Current recommendations. Sports Med. 26:207-216.
Ogan, D., and K. Pritchett (2013). Vitamin D and the athlete: risks, recommendations, and benefits. Nutrients 5:1856-1868.
Owen, J.A., Jr. (1975). Physiology of the menstrual cycle. Am. J. Clin. Nutr. 28:333-338.
Owens, D.J., R. Allison, and G.L. Close (2018). Vitamin D and the athlete: Current perspectives and new challenges. Sports Med. 48:3-16.
Papageorgiou, M., K.J. Elliott-Sale, A. Parsons, J.C.Y. Tang, J.P. Greeves, W.D. Fraser, and C. Sale (2017). Effects of reduced energy availability on bone metabolism in women and men. Bone. 105:191-199.
Peeling, P., B. Dawson, C. Goodman, G. Landers, and D. Trinder. (2008). Athletic induced iron deficiency: new insights into the role of inflammation, cytokines and hormones. Eur. J. Appl. Physiol. 103:381-391.
Peeling, P., M. Sim, and A.K.A McKay. (2023). Contemporary approaches to the identification and treatment of iron deficiency in athletes. Sports Sci. Exch. #000.
Rowe, P., A. Koller, and S. Sharma (2023). Physiology, bone remodeling. In: StatPearls. StatPearls Publishing.
Shahrokhi, S.Z., F. Ghaffari, and F. Kazerouni (2016). Role of vitamin D in female reproduction. Clin. Chim. Acta 455:33-38.
Shere, M., P. Bapat, C. Nickel, B. Kapur, and G. Koren (2015). Association between use of oral contraceptives and folate status: A systematic review and meta-analysis. J. Obstet. Gynaecol. Can. 37:430-438.
Sim, M., L.A. Garvican-Lewis, G.R. Cox, A. Govus, A.K. McKay, T. Stellingwerff, and P. Peeling (2019). Iron considerations for the athlete: a narrative review. Eur. J. Appl. Physiol. 119:1463-1478.
Smith, E.S., A.K.A. McKay, M. Kuikman, K.E. Ackerman, R. Harris, K.J. Elliott-Sale, T Stellingwerff, and L.M. Burke (2022). Managing female athlete health: Auditing the representation of female versus male participants among research in supplements to manage diagnosed micronutrient issues. Nutrients 14:3372.
Tan, J., C.-A. Ng, N.H. Hart, T. Rantalainen, M. Sim, D. Scott, K. Zhu, B. Hands, and P. Chivers (2023). Reduced peak bone mass in young adults with low motor competence. J. Bone Min. Res. Online ahead of print. PMID: 36795323.
Thomas, D.T., K.A. Erdman, and L.M. Burke (2016). Position of the academy of nutrition and dietetics, dietitians of Canada, and the American College of Sports Medicine: Nutrition and athletic performance. J. Acad. Nutr. Diet. 116:501-528.
Weaver, C.M., W.R. Proulx, and R. Heaney (1999). Choices for achieving adequate dietary calcium with a vegetarian diet. Am. J. Clin. Nutr. 70:543s-548s.
Yang, Q., J. Jian, S. Katz, S.B. Abramson, and X. Huang (2012). 17β-Estradiol inhibits iron hormone hepcidin through an estrogen responsive element half-site. Endocrinology 153:3170-3178.






