SSE #189: A DOENÇA CELÍACA, A SENSIBILIDADE AO GLÚTEN VERSUS O SENSACIONALISMO DO GLÚTEN E A REDUÇÃO DE CARBOIDRATOS “FODMAP” COMO INSTRUMENTO DE GERENCIAMENTO DE SINTOMAS GASTROINTESTINAIS EM ATLETAS
PONTOS-CHAVE:
- Sintomas gastrointestinais induzidos por exercícios são comumente relatados pelos atletas.
- Uma dieta livre de glúten (“glúten free”) para atletas que não necessitam da restrição clínica do glúten não mostrou ter um efeito negativo ou positivo na saúde gastrointestinal, no bem-estar geral ou na performance atlética.
- Os atletas podem efetivamente, ainda que inconscientemente, eliminar alimentos ricos em oligossacarídeos, dissacarídeos, monossacarídeos e polióis (FODMAPs) com o objetivo de reduzir os sintomas gastrointestinais.
- Uma dieta com baixo teor de carboidratos FODMAPs utilizada de maneira planejada, pode ser uma estratégia eficiente para reduzir a ocorrência ou intensidade dos sintomas gastrointestinais induzidos por exercícios.
A DIETA E A SÍNDROME GASTROINTESTINAL INDUZIDA PELO EXERCÍCIO
Entre os indivíduos participantes dos esportes de resistência, os sintomas gastrointestinais (SGI) são frequentemente relatados, desde sintomas leves à sintomas severos. A ocorrência de SGI moderados à severos foi relatada com uma taxa de variação de; 27% em maratonas, 32% em eventos Ironman e até 60-96% em eventos de resistência mais longos (por exemplo, corridas de ultramaratona), possivelmente comprometendo a performance (Costa et al., 2016; Pfeiffer et al., 2018; Stuempfle & Hoffman, 2015). Os atletas de resistência são os indivíduos mais pesquisados e relevantes; no entanto, os detalhes deste SSE são aplicados a muitos outros atletas que sofrem com sintomas GIs por diversas razões. SGI associados com o exercício são multifatoriais por natureza, passageiros e difíceis de se serem replicados. Os principais gatilhos para o conjunto de SGI do trato superior ou inferior são sugeridos de originarem-se em uma condição recente denominada “síndrome gastrointestinal induzida pelo exercício” (SGIE). Apesar do estresse do exercício ser um dos principais fatores prováveis de controlar o grau de perturbação do trato GI, inúmeros outros fatores provenientes da dieta podem influenciar a incidência e intensidade do SGI antes, durante e após o exercício. Estratégias nutricionais incluindo o momento apropriado para as refeições, dietas com pouco resíduo/baixo teor de fibras, “low-fat” e a ingestão moderada de proteínas são as estratégias geralmente implementadas para reduzir os SGI.
Uma das dietas mais populares recentemente e é a dieta “glúten free” (DGF), que cresceu em sua popularidade entre os atletas não-celíacos como uma solução para os SGI associados ao exercício, ainda que os dados que comprovem isso sejam limitados, e sendo a maioria das evidências que respaldam a eficácia pouco fundamentadas (Lis et al., 2015b; Newberry et al., 2017). Diversas alterações causadas pela dieta após a restrição de alimentos contendo glúten, podem ocorrer e influenciar a percepção dos efeitos benéficos desta dieta, que vão além da melhora da saúde intestinal (Lis et al., 2015b). A alteração mais notável como consequência desta dieta é uma redução do conteúdo de oligo, di e monossacarídeos e polióis (FODMAPs), principalmente os frutanos (Gibson et al., 2015). A redução da ingestão destes carboidratos de cadeia curta de difícil digestão antes, durante e possivelmente após o treino pode ser mais efetiva do que a restrição do glúten para tratar os SGI comumente relacionados aos exercícios em indivíduos suscetíveis (Gibson et al., 2015; Skodje et al., 2018). Devido ao consumo abrangente da DGF pelos atletas que não necessitam clinicamente deste tipo de dieta e os riscos associados com uma restrição dietética desnecessária, é pertinente a educação em relação à adequação da restrição do glúten e outras possíveis considerações nutricionais que são prováveis de modular os SGI. Este artigo do Sports Science Exchange (SSE) vai examinar os fundamentos dos SGI em atletas e o estado atual de conhecimento sobre a DGF para atletas que não necessitam deste tipo de dieta, mas responsabilizam o glúten pelos SGI. E ainda, será discutida no contexto esportivo a relação entre a restrição dos alimentos à base de trigo, a melhora dos SGI e os FODMAPs.
OS PRINCIPAIS GATILHOS PARA A SÍNDROME GASTROINTESTINAL INDUZIDA PELO EXERCÍCIO
Um reconhecimento geral das duas principais alterações fisiológicas induzidas pelo estresse gerado pelo exercício é fundamental para se considerar como os gatilhos dietéticos podem influenciar a severidade dos SGI e a complexidade de explorar essas alterações. Primeiramente, o exercício extenuante (exemplo, ciclismo em 70% da Wmax por 45 minutos) reduz o fluxo sanguíneo aos órgãos do trato GI; fato conhecido como hipoperfusão esplâncnica. À medida que o fluxo sanguíneo é desviado para longe dos órgãos da cavidade abdominal em direção aos músculos contráteis e circulação periférica, o suprimento insuficiente de sangue para o trato GI resulta numa isquemia (van Wijck et al., 2012). Lesões consequentes nas células epiteliais podem reduzir as capacidades funcionais, aumentar a permeabilidade da barreira intestinal, aumentar a resposta inflamatória e promover a desregulação epitelial (Dokladny et al., 2016; Zuhl et al., 2014). Em segundo lugar, a atividade aumentada das vias neuroendócrinas e gastrointestinais e a ativação elevada do sistema nervoso simpático podem reduzir o esvaziamento gástrico e retardar o trânsito orocecal (Costa et al., 2017a). As evidências ainda sugerem que como resultado do estresse associado ao exercício e a disfunção GI, alguns nutrientes são mal absorvidos e ainda adicionam complexidade às estratégias energéticas (Costa et al., 2017b; Lang et al., 2006; van Wijck et al., 2013).
O GLÚTEN E SINTOMAS GASTROINTESTINAIS
Existe um conjunto de informações baseadas em evidências e também crenças não fundamentadas sobre dietas, suplementos nutricionais, alimentos e comportamentos pré-exercício com o objetivo de prevenir ou reduzir os SGI associados ao exercício. Dentre estes, a restrição do glúten ganhou uma popularidade excessiva entre grupos de atletas (veja quadro abaixo para definição da DGF). Mais recentemente, um estudo internacional com quase mil atletas (n=910) mostrou que 41% deles relatou adesão a uma DGF em diferentes graus (Lis et al., 2015b). No entanto, faltam dados baseados em evidências para apoiar isso e apenas a comprovação anedótica dá suporte à sua eficácia.. Está além do escopo deste artigo discutir as condições clínicas específicas que necessitam de restrição do glúten. De qualquer forma, o número de atletas que relatou seguir uma DGF parece ser ~4 vezes maior do que a população geral estimada que realmente necessita clinicamente desta dieta livre de glúten (Caio et al., 2017). A restrição do glúten é essencial no gerenciamento de sinais, sintomas e saúde de indivíduos que apresentam condições clínicas como a doença celíaca, alergia ao trigo e sensibilidade genuína ao glúten não-celíaca. Por outro lado, entre atletas clinicamente saudáveis (ou atletas que fazem um autodiagnóstico de condições relacionadas ao glúten) há uma crença de que a DGF também ofereça os mesmos benefícios de saúde. Enquanto isto não foi demonstrado, é interessante considerar o único elemento em atletas participantes de treinamentos de alta intensidade que sofrem estresse de repetição nos intestinos. Teoricamente, um estado persistente de diversos níveis de lesão intestinal pode aumentar a sensibilidade aos gatilhos dietéticos já conhecidos, ou associados com o desenvolvimento de doenças crônicas (por exemplo, distúrbio funcional do GI) de maneira aguda ou após ocorrências repetitivas (Costa et al., 2017a). Devido à atual falta de biomarcadores para diagnóstico da sensibilidade ao glúten não-celíaca e um árduo processo de diagnóstico, muitos atletas fazem um autodiagnóstico desta condição e consequentemente adotam uma DGF sem precisamente estabelecer os mecanismos implícitos.
| Dieta livre de glúten (glúten free): uma DGF rígida elimina todas as fontes de glúten, uma proteína de armazenamento composta pelas gliadinas solúveis em álcool definidas como prolaminas e as gluteninas insolúveis em álcool como glutelinas. Há diversas condições clínicas que necessitam de uma dieta “glúten free”. Estas incluem a doença celíaca, alergia ao trigo, ataxia do glúten e sensibilidade ao glúten não-celíaca (Newberry et al., 2017; Vici et al., 2016). |
Além dos sintomas GIs, acredita-se que a DGF, mesmo sem necessidade clínica, possa melhorar a saúde GI e os sintomas, reduzindo a inflamação, ser uma dieta mais saudável em geral e oferecer uma vantagem ergogênica (Lis et al., 2015b). Até o momento, o único estudo abrangente foi conduzido em atletas não-celíacos. Neste estudo crossover randomizado duplo-cego, ciclistas não-celíacos seguiram uma dieta a curto prazo contendo glúten ou dieta “glúten free” com um período de 10 dias de “limpeza” entre as intervenções. Apesar da dieta rigidamente controlada e replicada e os regimes de exercício, não foram observadas diferenças nas medidas de lesões GIs, SGI, respostas inflamatórias sistêmicas, percepção de bem-estar ou performance no teste de tempo individual na comparação entre as dietas (Lis et al., 2015a). Enquanto em muitos grupos de atletas os benefícios da restrição do glúten continuam sendo valorizados, uma DGF independente de uma condição clínica não mostrou ter efeitos positivos ou negativos (Lis et al., 2015a). Para futuro gerenciamento desta dieta em atletas clinicamente saudáveis é também importante considerar outras alterações dietéticas na prática que provavelmente acontecem junto da restrição do glúten, que podem ter um papel na influência dos benefícios percebidos ou reais desta dieta (Figura 1).
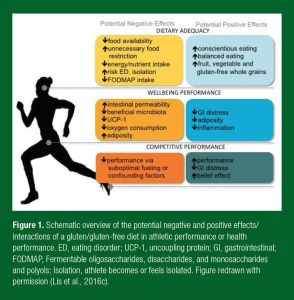
Figura 1. Resumo esquemático dos possíveis efeitos negativos e positivos e interações de uma dieta com glúten e “glúten free” na saúde e performance atlética. ED, distúrbio alimentar; UCP-1, proteína desacopladora; GI, gastrointestinal; FODMAP, oligossacarídeos, dissacarídeos, monossacarídeos e polióis fermentáveis; Isolamento, atleta se torna ou se sente isolado. Figura utilizada com permissão (Lis et al., 2016c).
Tradução:
| Possíveis Efeitos Negativos | Possíveis Efeitos Positivos |
| ADEQUAÇÃO DIETÉTICA | |
| ↓ disponibilidade de alimentos
↑ restrição alimentar desnecessária ↓ ingestão de energia e nutrientes ↑ risco de ED, isolamento ↓ ingestão de FODMAPs |
↑ alimentação consciente
↑ alimentação equilibrada ↑ frutas, hortaliças e grãos integrais “glúten free” |
| DESEMPENHO DA SAÚDE | |
| ↑ permeabilidade intestinal
↓ microbiota benéfica ↓ UCP-1 ↓ consumo de oxigênio ↑ adiposidade |
↓ dificuldade GI
↓ adiposidade ↓ inflamação |
| PERFORMANCE COMPETITIVA | |
| ↓ performance através de consumo energético abaixo do ideal ou fatores de confusão | ↑ performance
↓ dificuldade GI ↑ efeito de convicção |
CONSIDERAÇÕES DIETÉTICAS PARA A DGF EM ATLETAS
Riscos estão associados com o autodiagnóstico de condições clínicas relacionadas ao glúten e a adoção consecutiva de uma DGF, já que a possível condição médica ou fisiológica inerente poderia ser negligenciada. Muitos desafios nutricionais também têm sido associados com a restrição de alimentos que contêm glúten (Figura 1). De especial relevância para os atletas é o possível risco da restrição alimentar desnecessária comprometendo a ingestão de energia e nutrientes, gerando comportamento alimentar restritivo ou distúrbios alimentares relacionados (Cialdella-Kam et al., 2016; Hill et al., 2017). Enquanto o mercado “glúten free” aumentou drasticamente a qualidade e a quantidade dos alimentos que são livres de glúten em muitas partes do mundo, a preocupação permanece pertinente a ingestão reduzida de prebióticos e os impactos concomitantes na microbiota intestinal (Gaesser & Angadi, 2012; Vici et al., 2016). Em contrapartida, diversos elementos positivos têm sido atribuídos sem fundamentos à uma DGF. Os atletas indicam que a DGF melhorou o equilíbrio dietético, em geral, e a ingestão de frutas, hortaliças e grãos integrais sem glúten. Estes são todos princípios subjacentes dos fundamentos da nutrição esportiva saudável (Lis et al., 2015b). Estes hábitos alimentares positivos podem ser atribuídos simplesmente ao seguimento das diretrizes nutricionais e podem não ser sustentados em longo prazo. Portanto, a adequação de uma DGF deve ser considerada individualmente e orientada por um profissional de nutrição que se baseia em evidências (exemplo, nutricionistas esportivos registrados e especialistas em nutrição esportiva (Lis et al., 2016c)). Infelizmente, conselhos não acadêmicos provavelmente estão fundamentalmente influenciando as decisões sobre a DGF dos atletas e frequentemente não têm a individualização necessária para otimizar a ingestão dietética como suporte para a performance atlética máxima (Lis et al., 2015b).
A DGF COM RELAÇÃO AOS FODMAPs
Uma abordagem detalhada baseada em evidências para a detecção da adequação da adesão à uma DGF pode ajudar a identificar os gatilhos exatos para os SGI e sintomas relacionados. Curiosamente, a ingestão de FODMAPs, especificamente frutanos, é reduzida ou eliminada acompanhando a restrição de grãos livres de glúten. É bem provável que a redução no conteúdo de FODMAPs é o fator de modulação para a melhora dos sintomas em uma dieta DGF (restrição de grãos à base de trigo), e não especificamente o glúten isoladamente (Gibson et al., 2015; Skodje et al., 2018). Este conceito é bastante respaldado por diversos estudos clínicos e editoriais científicos sugerindo que uma redução na ingestão de FODMAPs é responsável pelas melhoras nos SGI e que o glúten isoladamente não é o fator de modulação (Gibson et al., 2015; Hill et al., 2017; Skodje et al., 2018). Skodje et al. (2018) recentemente demonstrou que os frutanos foram gatilhos para SGI semelhantes aos da síndrome do colón irritável (SCI) em um número de indivíduos com sensibilidade ao glúten não-celíaca autodiagnosticada duas vezes maior que o glúten. Uma dieta com baixo teor de FODMAPs é utilizada como primeira estratégia para o tratamento de SCI sintomático com 70% dos indivíduos com SCI relatando sucesso na redução dos sintomas (Staudacher et al., 2017). Considerando que atletas de resistência experimentam sintomas análogos ao conjunto de SGI do trato superior e inferior representativos do SCI (exemplo, pressão intragástrica, flatulência excessiva, inchaço e dor no abdômen inferior, urgência para defecar, alterações nos movimentos intestinais e fezes aguadas ou perda anormal de fezes), a redução estratégica de FODMAPs está surgindo como uma ferramenta dietética promissora para tratar os SGI associados ao exercício em atletas de resistência clinicamente saudáveis (Costa et al., 2017; Lis et al., 2016b; 2017; Masuy et al., 2018).
| FODMAP: oligo, di e monossacarídeos e polióis fermentáveis (FODMAPs) são carboidratos de cadeia curta que são absorvidos diversificadamente no intestino delgado. Eles estão presentes na dieta de maneira abundante e incluem o monossacarídeo (frutose), dissacarídeo (lactose), oligossacarídeos (frutanos e galactanos) e polióis. Os FODMAPs são pouco absorvidos ou absorvidos de forma variada, aumentando a oferta de substratos facilmente fermentáveis e água para o intestinal delgado distal e cólon proximal, e provavelmente induzem distensão luminal e indução dos sintomas funcionais intestinais (Gibson & Shepherd, 2010). |
Em uma população geral saudável os FODMAPs podem não ser bem digeridos, mas as implicações são inexistentes ou insignificantes (Ong et al., 2010; Staudacher et al., 2017). Como descrito acima, a ingestão de FODMAPs por atletas que estão submetidos a exercícios extenuantes e sofrendo debilitação associada aos componentes alimentares não digeridos pela função GI podem aumentar a carga osmótica no intestino delgado e contribuir com a maior translocação osmótica da água, volume e consequências fisiológicas como fezes amolecidas ou diarreia (Gibson & Shepherd, 2010). Uma ingestão de FODMAPs pode também aumentar os SGI iniciados pelos efeitos osmóticos da maior ingestão de carboidratos necessários para suprir as demandas energéticas (Jeukendrup & McLaughlin, 2010). Ao longo do trânsito para o intestino mais distante, alimentos com carboidratos mal absorvidos e altamente fermentáveis alcançam o cólon e são sujeitos à fermentação bacteriana (quebra), possivelmente aumentando a pressão luminal pelo aumento da produção e volume de gás no cólon (exemplo, H2, CH4, CO2 e H2S) e translocação osmótica da água. Os sintomas resultantes incluem inchaço, pressão e dor abdominal inferior, urgência para defecar etc. Os SGI inferiores são mais comumente relatados entre atletas, especialmente corredores. No entanto, os SGI superiores como sensação de estar saciado ou inchaço também são frequentemente testemunhados. Até recentemente, os efeitos negativos dos FODMAPs no trato GI superior foram minimamente investigados. Um estudo clínico recente utilizou uma técnica de infusão gástrica para ofertar frutose e glicose ao estômago em pacientes com SCI assim como indivíduos saudáveis como controle e mediu a pressão intragástrica, SGI e bem-estar psicossomático (Masuy et al., 2018). A pressão gástrica pós-prandial foi maior com a frutose em comparação com a glicose em ambos os grupos além de escores mais altos para sintomas no grupo com SCI para inchaço, cólicas, dor abdominal e flatulência (Masuy et al., 2018). Enquanto achados clínicos podem não ser diretamente transferíveis para atletas saudáveis, a semelhança dos sintomas e alterações comuns na função GI permitem um cruzamento substancial dos achados da pesquisa para as ferramentas de gerenciamento relacionadas (Lis et al., 2017; Masuy et al., 2018).
PESQUISAS SOBRE DIETAS POBRES EM FODMAPS EM ATLETAS
Um grupo de estudos tem examinado o impacto da ingestão de FODMAPs nos SGI em atletas clinicamente saudáveis. Como discutido de forma anedótica entre grupos de ciências do esporte, os atletas frequentemente implementam estratégias além das curvas provenientes das pesquisas. Como suporte para este conceito, dados de um questionário preliminar quantificou que 55% de 910 atletas eliminaram pelo menos um alimento com alto teor de FODMAP com o objetivo de reduzir SGI e 83% de um grupo de 501 atletas relatou sucesso na redução de sintomas pela remoção do alimento ou de alimentos agressivos (Lis et al., 2016a). Reportes de estudos de casos e um estudo de intervenção publicado encorajam a utilização de uma dieta pobre em FODMAPs em comparação com a dieta habitual (normalmente alta em FODMAPs) para impactar positivamente os SGI (Gaskell & Costa, 2018; Lis et al., 2016b). Um estudo pioneiro que examinou o papel do impacto do consumo de FODMAPs nos SGI em corredores saudáveis demonstrou que 82% dos corredores (9 de 11) com autodiagnóstico para SGI persistentes associados ao exercício sofreram SGI diários significativamente menores (fora do exercício) durante o período de intervenção com baixa quantidade de FODMAPs em comparação com dieta rica em FODMAPs (Lis et al., 2017). Curiosamente, SGI durante corridas extenuantes não foram significativamente diferentes e isto pode ser devido ao exercício prescrito necessitar ser mais longo ou de maior intensidade para distinguir diferenças nos sintomas entre as dietas. Além disso, os SGI às vezes se torna aparente depois de uma sessão de treino/corrida extenuante possivelmente influenciando o abastecimento energético para os eventos consecutivos. Os sintomas gastrointestinais fora de uma sessão de exercício são preocupantes em eventos de atletismo onde há competições diversas vezes ao dia ou que acontecem por diversos dias. Apesar dos SGI serem difíceis de replicar e passageiros por natureza, evidências recentes estão sem dúvidas apontando em direção a um papel benéfico da modulação de FODMAPs para alguns atletas com SGIE.
DIETA POBRE EM FODMAPS PARA ATLETAS CLINICAMENTE SAUDÁVEIS
Metodologias atuais implemetam uma dieta de 1-3 dias, com baixa quantidade de FODMAPs, anteriormente ao exercício extenuante ou competições/eventos (Costa et al., 2017b; Stuempfle & Hoffman, 2015). A lógica para este período é que os FODMAPs já provavelmente teriam sido limpos do trato GI neste intervalo de tempo. Para estudos que investigam intervenções nutricionais e de exercício para os SGI, uma dieta com baixo teor de FODMAPs é vista por criar uma dieta de referência uniforme onde o mínimo de SGI poderia ser provocado ou aumentado pela carga de FODMAPs da dieta antecedente. A quantificação de uma dieta com baixo conteúdo de FODMAPs para um atleta clinicamente saudável (exemplo, sem distúrbio funcional como a SCI) não foi estabelecida. Recomendações <0,5g de FODMAPs por refeição são baseadas em estudos clínicos conduzidos em uma população com SCI (Varney et al., 2017). É aceitável que em atletas, especialmente atletas de resistência, a ingestão de FODMAPs seja muito mais alta que os valores utilizados para classificar uma dieta como pobre ou rica em FODMAPs em configurações clínicas (Ong et al., 2010), e ainda que as diretrizes seriam diferentes. Lis et al. (2017) demonstrou que a ingestão habitual de FODMAPs em corredores com SGIE autodiagnosticados foi 2 vezes maior que as dietas classificadas clinicamente como ricas em FODMAPs (43g/dia). A ingestão habitual de FODMAPs por atletas de resistência pode ser significativamente maior do que a média da população devido ao aumento da ingestão alimentar de maneira geral; à alta ingestão de grãos à base de trigo/barras de energia; alta ingestão de frutas e hortaliças; barras proteicas; laticínios provenientes do leite de vaca como fonte de proteína de qualidade e produtos alimentares esportivos para atingir as demandas energéticas e de nutrientes, e devido às complexidades logísticas de suprimento de energia para o esporte. Uma dieta pobre em FODMAPs pode incialmente apresentar desafios para ser aplicada e pode ser bastante restritiva. E é, portanto, recomendado que atletas considerando a redução de FODMAPs para diminuir SGI deveriam consultar um profissional de nutrição adequadamente capacitado (exemplo, nutricionistas registrados, especializados em esportes com certificação em dietas com baixo teor de FODMAPs para treinamentos). A figura 2 sugere uma breve estratégia de implementação como caminho de uma dieta com baixo teor de FODMAPs em atletas com SGIE. Este caminho sugerido precisa ser individualizado e provavelmente terá rápida evolução concomitante às pesquisas recentes.
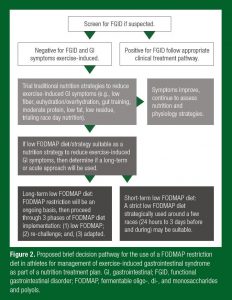
Figura 2. Proposta de um breve caminho de decisão para a utilização de uma dieta com restrição de FODMAPs em atletas para plano de gerenciamento da síndrome gastrointestinal induzida pelo exercício. GI, gastrointestinal; FGID, distúrbio gastrointestinal funcional; FODMAP, oligossacarídeos, dissacarídeos, monossacarídeos e polióis fermentáveis.
Tradução (ordem de leitura da esquerda para direita, por linha):
Rastrear FGID em caso de suspeita;
Negativo para FGID e sintomas GIs induzidos pelo exercício // Positivo para FGID; seguir caminho de tratamento clínico adequado.
Teste com estratégias nutricionais tradicionais para reduzir sintomas GIs induzidos pelo exercício (exemplo, baixo teor de fibras, hidratação normal/hidratação excessiva, habituação intestinal, quantidade moderada de proteínas, baixo teor de gorduras, pouco resíduo, nutrição experimental para dia de corrida).
Na melhora dos sintomas, continue a avaliar estratégias de nutrição e fisiológicas.
Se a dieta/estratégia com baixa quantidade de FODMAPs for adequada como estratégia nutricional para redução dos sintomas GIs induzidos pelo exercício, então determinar se abordagem será utilizada a longo-prazo ou curto-prazo.
Dieta com baixo teor de FODMAPs a longo-prazo: Restrição de FODMAPs contínua, então proceder através das 3 fases de implementação da dieta FODMAPS: (1) baixo teor de FODMAP; (2) avaliar novamente; e, (3) adaptar.
Dieta com baixo teor de FODMAPs por curto período de tempo: uma dieta severa com baixo conteúdo de FODMAPs utilizada estrategicamente em torno de algumas corridas (3 dias a 24 horas antes e durante) pode ser apropriada.
Atletas são muito diferentes de uma população clínica, o que tem sido o principal foco da pesquisa em dietas com baixas quantidades de FODMAPs. No entanto, atletas são suscetíveis a muitos dos mesmos possíveis inconvenientes provenientes de uma dieta a longo prazo e restrita, com baixo teor de FODMAPs, como discutido na pesquisa clínica, e estes deveriam ser avaliados antes e ao longo da implementação desta dieta (Hill & Gibson, 2017; Lis et al., 2017). Dependendo da abrangência da alta restrição alimentar de FODMAPs, diversas complicações associadas à uma dieta a longo prazo baixa em FODMAPs foram identificadas. A restrição severa de FODMAPs pode estar associada com alterações na microbiota intestinal, produção reduzida de ácidos graxos de cadeia curta , assim como efeitos nos aspectos físicos e fisiológicos do bem-estar, similares àqueles mencionados acima com relação à uma DGF (Halmos et al., 2015; Lis et al., 2017; Staudacher et al., 2017). Um efeito benéfico do exercício na microbiota intestinal tem sido demonstrado, mas não é conhecido se este efeito é protetor contra as concentrações menores de bifidobactérias que são encontradas após 3-4 semanas de ingestão reduzida de FODMAPs (Lambert et al., 2015; Staudacher et al., 2017). Além disso, a coadministração de probiótico com múltiplas cepas, um suplemento comumente utilizado por atletas, também mostrou ter eficácia em atenuar os efeitos prejudiciais da menor ingestão de fibras prebióticas (Staudacher et al., 2017). A ingestão reduzida de prebióticos pode influenciar ainda a produção de ácidos graxos de cadeia curta que são altamente dependentes da fermentação de carboidratos não digeridos no intestino grosso (Wong et al., 2006). A importância da saúde intestinal do atleta está se tornando mais aparente com o aumento do reconhecimento da multiplicidade dietética, fatores psicológicos e ambientais que influenciam a composição e atividade metabólica da microbiota intestinal e os parâmetros de saúde interconectados. A ingestão de carboidratos de cadeia curta é apenas um destes componentes. É prudente considerar estes aspectos da saúde intestinal quando se implementar adesão frequente ou a longo prazo às dietas com restrições de FODMAPs. Além disso, a limitação dietética excessiva e a adesão à dietas restritivas são atribuídas à práticas alimentares restritivas (exemplo, ortorexia nervosa) e um maior risco de distúrbios alimentares (Cialdella-Kam et al., 2016; Hill et al., 2017), que podem ser prejudiciais à saúde e performance do atleta (Mountjoy et al., 2018). Este conceito é fundamental na adesão à qualquer dieta com o propósito de melhorar a saúde, já que tem potencial de causar mais danos do que benefícios por gerar complicações dietéticas, nutricionais e psicossociais. Os objetivos principais de implementar uma DGF ou dieta pobre em FODMAPs para gerenciar os SGI deveria ser o de estabelecer um mecanismo implícito e minimizar restrições alimentares desnecessárias e os riscos nutricionais/psicossociais associados. A troca de alimentos que contêm alto teor de FODMAPs e que contêm glúten comumente presentes nas dietas dos atletas e alimentos apropriados em relação ao baixo teor de FODMAPs estão destacados na Tabela 1.
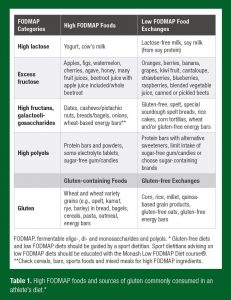
Tradução:
| Categoria FODMAP | Alimentos com alto teor de FODMAPs | Troca alimentar com baixa quantidade de FODMAPs |
| Lactose alta | Iogurte, leite de vaca | Leite sem lactose, leite de soja (da proteína da soja) |
| Frutose excessiva | Maçã, figo, melancia, cereja, agave, mel, muitos sucos de fruta, suco de beterraba com suco de maçã incluso/beterraba inteira | Laranja, frutas vermelhas, banana, uva, kiwi, melão cantaloupe, morango, mirtilo, framboesa, suco misturado com hortaliças, beterraba enlatada ou em conserva |
| Frutanos e galacto-oligossacarídeos altos | Tâmara, castanha de caju/pistache, pães/bagels, cebola, barras energéticas à base de trigo** | Pães sem glúten, com trigo espelta ou especiais de fermentação natural com trigo espelta sem glúten, bolo de arroz, tortilhas de milho, barras energéticas sem trigo ou glúten |
| Polióis altos | Barras de proteína e pós, alguns tabletes de eletrólitos, gomas e doces sem açúcar | Barras de proteínas com adoçantes alternativos, ingestão limitada de gomas/doces sem açúcar ou escolha de marcas contendo açúcar |
| Alimentos que contêm glúten | Trocas “glúten-free” | |
| Glúten | Produtos de trigo ou à base de trigo (exemplo, trigo espelta, kamut, centeio, cevada) como pães, bagels, cereais, massas, aveia, barras energéticas | Milho, arroz, painço, produtos à base de quinua, aveias livres de glúten, barras energéticas livres de glúten |
FODMAP, oligo, di e monossacarídeos e polióis fermentáveis. * Dietas livres de glúten e baixo teor de FODMAPs devem ser orientadas por um nutricionista esportivo. Nutricionistas esportivos que recomendam dietas com baixo teor de FODMAPs deveriam participar do curso Dieta Monash com baixo teor de FODMAPs®. **Checar cereais, barras, alimentos esportivos e refeições mistas para ingredientes com altas quantidades de FODMAPs.
Tabela 1. Alimentos com alto teor de FODMAPs e fontes de glúten normalmente consumidos na dieta de um atleta*.
CONSIDERAÇÕES PRÁTICAS
- Tenha como objetivo um diagnóstico apropriado das condições relacionadas ao glúten e corrija os gatilhos alimentares (por exemplo, FODMAPs/frutanos) antes de escolher uma dieta “glúten free” ou com baixo teor de FODMAPs desnecessariamente.
- Alguns atletas com SGIE podem se beneficiar com uma dieta modificada pobre em FODMAPs. O auxílio proveniente de recomendações de profissionais capacitados como nutricionistas e especializados em nutrição esportiva e em dieta com baixo teor de FODMAPs podem facilitar a eficácia e a utilização adequada da dieta e evitar a restrição desnecessária ou complicações associadas com as restrições alimentares.
- Os atletas que obtém benefícios da redução de FODMAPs provavelmente necessitam de planejamento dietético modificado envolvendo alimentos específicos ricos em FODMAPs e não uma forma de dieta mais restritiva. Por exemplo, a lactose e a frutose podem ser os gatilhos mais comuns e a redução de apenas altas quantidades de lactose e excesso de frutose pode ser suficiente para a melhora dos sintomas. Por outro lado, a utilização por pouco tempo de dietas rígidas e pobres em FODMAPs por 1-3 dias anteriormente e durante exercícios intensos de resistência pode ser necessária para a redução adequada dos sintomas.
- Para oferta ideal de nutrientes na fase de recuperação (reposição de carboidratos), a restrição de alimentos ricos em FODMAPs pode também ser vantajosa.
- A atenção com a restrição alimentar possivelmente desnecessária que contribui para o desenvolvimento de distúrbios alimentares deve ser cuidadosamente abordada quando se utilizar uma DGF ou dietas pobres em FODMAPs.
REFERÊNCIAS
Caio, G., G. Riegler, M. Patturelli, A. Facchiano, D.E. Magistris, and A. Sapone (2017). Pathophysiology of non-celiac gluten sensitivity: Where are we now? Minerva Gastroenterol. Dietol. 63:16-21.
Cialdella-Kam, L., D. Kulpins, and M.M. Manore (2016). Vegetarian, gluten-free, and energy restricted diets in female athletes. Sports 4:50.
Costa, R.J., R. Snipe, V. Camoes-Costa, V. Scheer, and A. Murray (2016). The impact of gastrointestinal symptoms and dermatological injuries on nutritional intake and hydration status during ultramarathon events. Sports Med. Open 2:16.
Costa, R.J.S., R.M.J. Snipe, C.M. Kitic, and P.R. Gibson (2017a). Systematic review: Exercise-induced gastrointestinal syndrome-implications for health and intestinal disease. Aliment. Pharmacol. Ther. 46:246-265.
Costa, R.J.S., A. Miall, A. Khoo, C. Rauch, R. Snipe, V. Camoes-Costa, and P. Gibson (2017b). Gut-training: The impact of two weeks repetitive gut-challenge during exercise on gastrointestinal status, glucose availability, fuel kinetics, and running performance. Appl. Physiol. Nutr. Metab. 42:547-557.
Dokladny, K., M.N. Zuhl, and P.L. Moseley (2016). Intestinal epithelial barrier function and tight junction proteins with heat and exercise. J. Appl. Physiol. 120:692-701.
Gaesser, G.A., and S.S. Angadi (2012). Gluten-free diet: Imprudent dietary advice for the general population? J. Acad. Nutr. Diet. 112:1330-1333.
Gaskell, S.K., and R.J.S. Costa (2018). Applying a low-fodmap dietary intervention to a female ultra-endurance runner with irritable bowel syndrome during a multi-stage ultra-marathon. Int. J. Sport Nutr. Exerc. Metab. 14: Epub ahead of print.
Gibson, P.R., and S.J. Shepherd (2010). Evidence-based dietary management of functional gastrointestinal symptoms: The fodmap approach. J. Gastroenterol. Hepatol. 25:252-258.
Gibson, P.R., J.G. Muir, and E.D. Newnham (2015). Other dietary confounders: Fodmaps et al. Dig. Dis. 33:269-276.
Halmos, E.P. C.T. Christophersen, A.R. Bird, S.J. Shepherd, P.R. Gibson, and J.G Muir (2015). Diets that differ in their fodmap content alter the colonic luminal microenvironment. Gut 64:93-100.
Hill, P., J.G. Muir, and P.R. Gibson (2017). Controversies and recent developments of the low-fodmap diet. Gastroenterol. Hepatol. 13:36-45.
Jeukendrup, A.E., and J. McLaughlin (2010). Carbohydrate ingestion during exercise: Effects on performance, training adaptations and trainability of the gut. Nestle Nutr. Inst. Workshop Ser. 69:1-12.
Lambert, J.E., J.P. Myslicki, M.R. Bomhof, D.D. Belke, J. Shearer, and R.A. Reimer (2015). Exercise training modifies gut microbiota in normal and diabetic mice. Appl. Physiol. Nutr. Metab. 40:749-752.
Lang, J.A., C.V. Gisolfi, and G.P. Lambert (2006). Effect of exercise intensity on active and passive glucose absorption. Int. J. Sport Nutr. Exerc. Metab. 16:485-493.
Lis, D., T. Stellingwerff, C.M. Kitic, K.D. Ahuja, and J. Fell, (2015a) No effects of a short-term gluten-free diet on performance in non-celiac athletes. Med. Sci. Sports Exerc. 47:2563-2570.
Lis, D., T. Stellingwerff, C.M. Shing, K.D.K. Ahuja, and J. Fell (2015b). Exploring the popularity, experiences, and beliefs surrounding gluten-free diets in nonceliac athletes. Int. J. Sport Nutr. Exerc. Metab. 25:37-45.
Lis, D., K.D. Ahuja, T. Stellingwerff, C.M. Kitic, and J. Fell (2016a). Food avoidance in
athletes: Fodmap foods on the list. Appl. Physiol. Nutr. Metab. 41:1002-1004.
Lis, D.M., K.D. Ahuja, T. Stellingwerff, C.M. Kitic, and J. Fell (2016b). Case study: Utilizing a
low fodmap diet to combat exercise-induced gastrointestinal symptoms: Med. Sci. Sports
Exerc. 48:965 (abstract).
Lis, D., J.W. Fell, K.D.K. Ahuja, D.K. Kiran., C. Kitic, and T. Stellingwerff (2016c).
Commercial hype versus reality: our current scientific understanding of gluten and
athletic performance. Curr. Sports Med. Rep. 15:262-268.
Lis, D.M., T. Stellingwerff, C.M. Kitic, J.W. Fell, and K.D.K. Ahuja (2017). Low fodmap: A
preliminary strategy to reduce gastrointestinal distress in athletes. Med. Sci. Sports Exerc.
50:116-123.
Masuy, I., L.Van Oudenhove, J. Tack, and J.R. Biesiekierski (2018). Effect of intragastric
fodmap infusion on upper gastrointestinal motility, gastrointestinal, and psychological
symptoms in irritable bowel syndrome vs healthy controls. Neurogastroenterol. Motil.
30: Epub ahead of print.
Mountjoy, M., J.K. Sundgot-Borgen, L.M. Burke, K.E. Ackerman, C. Blauwet, N. Constantini, C. Lebrun, B. Lundy, A.K. Melin, N.L. Meyer, R.T. Sherman, A.S. Tenforde, M. Klungland, M. Torstveit, and R. Budgett (2018).IOC consensus statement on relative energy deficiency in sport (red-s): 2018 update. Br. J. Sports Med. 52:687-697.
Newberry, C., L. McKnight, M. Sarav, and O. Pickett-Blakely (2017). Going gluten free: The history and nutritional implications of today’s most popular diet. Curr. Gastroenterol. Rep. 19:54.
Ong, D.K., S.B. Mitchell, J.S. Barrett, S.J. Shepherd, P.M. Irving, J.R. Biesiekierski, S. Smith, P.R. Gibson, and J.G. Muir (2010). Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome. J. Gastroenterol. Hepatol. 25:1366-1373.
Pfeiffer, B., T. Stellingwerff, A.B. Hodgson, R. Randell, K. Pottgen, P. Res, and A.E. Jeukendrup (2012). Nutritional intake and gastrointestinal problems during competitive endurance events. Med. Sci. Sports Exerc. 44:344-351.
Pugh, J.N., B. Kirk, R. Fearn, J.P. Morton, and G.L. Close (2018). Prevalence, severity and potential nutritional causes of gastrointestinal symptoms during a marathon in recreational runners. Nutrients 10:7.
Skodje, G.I., V.K. Sarna, I.H. Minelle, K.L. Rolfsen, J.G. Muir, P.R. Gibson, M.B. Veierod, C. Henriksen, and K.E.A. Lundin (2018). Fructan, rather than gluten, induces symptoms in patients with self-reported non-celiac gluten sensitivity. Gastroenterology 155:228.
Staudacher, H.M., M.C.E. Lomer, F.M. Farquharson, P. Louis, F. Fava, E. Franciosi, M. Scholz, K.M. Tuohy, J.O. Lindsay, P.M. Irving, and K. Whelan (2017). A diet low in fodmaps reduces symptoms in patients with irritable bowel syndrome and a probiotic restores bifidobacterium species: A randomized controlled trial. Gastroenterology 153:936-947.
Stuempfle, K.J., and M.D. Hoffman (2015). Gastrointestinal distress is common during a 161-km ultramarathon. J. Sports Sci. 33:1814-1821.
van Wijck, K., K. Lenaerts, J. Grootjans, K.A, Wijnands, M. Poeze, L.J. van Loon, C.H. Dejong, and W.A. Buurman (2012). Physiology and pathophysiology of splanchnic hypoperfusion and intestinal injury during exercise: Strategies for evaluation and prevention. Am. J. Physiol. 303:G155-G168.
van Wijck, K., B. Pennings, A.A. van Bijnen, J.M. Senden, W.A. Buurman, C.H. Dejong, L.J. van Loon, and K. Lenaerts (2013). Dietary protein digestion and absorption are impaired during acute postexercise recovery in young men. Am. J. Physiol. 304:R356-R361.
Varney, J., J. Barrett, K. Scarlata, P. Catsos, P.R. Gibson, and J.G. Muir (2017). Fodmaps: Food composition, defining cutoff values and international application. J. Gastroenterol. Hepatol. 32(Suppl 1):53-61.
Vici, G., L. Belli, M. Biondi, and V. Polzonetti (2016). Gluten free diet and nutrient deficiencies: A review. Clin. Nutr. 35:1236-1241.
Wong, J.M., R. de Souza, C.W. Kendall, A. Emam, and D.J. Jenkins (2006). Colonic health: Fermentation and short chain fatty acids. J. Clin. Gastroenterol. 40:235-243.
Zuhl, M., S. Schneider, K. Lanphere, C. Conn, K. Dokladny, and P. Moseley (2014). Exercise regulation of intestinal tight junction proteins. Br. J. Sports Med. 48:980-986.






