SSE #198: NUTRIÇÃO E A SAÚDE IMUNOLÓGICA DO ATLETA: UMA NOVA PERSPECTIVA
Publicado em
October 2019
Autor
Neil P. Walsh PhD, FACSM
PONTOS CHAVE:
- A ausência em treinamentos causada por enfermidades é incompatível com o sucesso em esportes de elite, que possuem grande demanda de treinos regulares; ou seja, quanto menos doente o atleta fica, mais ele pode treinar.
- Os medalhistas dos maiores eventos de esporte, incluindo os Jogos Olímpicos e os Campeonatos Mundiais, sofrem um menor número de infecções respiratórias e com episódios com menor duração do que atletas de menor sucesso em competições nacionais.
- A disponibilidade de nutrientes influencia a imunidade porque macro e micronutrientes estão envolvidos em múltiplos processos imunológicos. Macronutrientes estão envolvidos no metabolismo imunológico celular e na síntese proteica e micronutrientes estão envolvidos nas defesas antioxidantes.
- Existe um novo paradigma para a imunologia do exercício, que considera a resistência (a força do sistema imunológico) e tolerância (a habilidade de resistir aos micróbios e atenuar a atividade de defesa).
- Uma visão contemporânea é que a resistência imunológica não está suprimida em atletas que realizam treinos intensos, então não é de se surpreender que suplementos nutricionais que visam a melhora da resistência imunológica mostrem poucos benefícios na redução da carga das infecções em atletas – “se não está quebrado, não tente consertar!”, do inglês “if it ain’t broken, don’t fix it!”.
- Este novo paradigma da resistência e tolerância ajuda a explicar o porquê dos suplementos nutricionais com efeito tolerogênico (ou seja, sua capacidade de gerar tolerância imunológica, como por exemplo, os probióticos, a vitamina C e vitamina D) serem os novos alvos de pesquisas, já que esses suplementos podem reduzir a carga das infecções nos atletas.
INTRODUÇÃO
O objetivo deste artigo do Sports Science Exchange (SSE) é fornecer uma nova perspectiva teórica e assim melhorar o nosso entendimento sobre como a nutrição pode influenciar a saúde imunológica do atleta. Neste contexto, serão discutidos e analisados os avanços recentes do nosso entendimento sobre a carga das infecções em atletas e fatores de risco relevantes para as infecções. Assim como a visão mais antiga demasiadamente simplista, sustentada por muitos, de que os suplementos nutricionais devem focar em atenuar o aparato imunológico supostamente enfraquecido (resistência) em atletas de elite considerados saudáveis. Este novo paradigma para a imunologia do exercício, recentemente adotado pela imunologia humana proveniente da imunologia ecológica, será apresentado e considera que as interações tolerogênicas entre patógenos e o sistema imunológico sejam benéficas (a tolerância se refere a habilidade de resistir aos micróbios). Dentro deste contexto, nos é apresentado um cenário muito mais claro em relação aos achados, bastante conflituosos e frequentemente desanimadores, resultantes dos estudos que investigam os suplementos nutricionais e a saúde imunológica do atleta. Esta recente perspectiva teórica fornece uma nova estrutura para pesquisas sobre estes suplementos nutricionais tolerogênicos com o intuito de reduzir a carga das infecções em atletas de elite.
AS INFECÇÕES CONSTITUEM UM SÉRIO PROBLEMA AOS ATLETAS
Uma Infecção do Trato Respiratório Superior (ITRS), como um resfriado comum, pode apresentar apenas um incômodo indesejado para a maioria de nós. No entanto, uma ITRS e outras infecções como aquelas que afetam o sistema gastrointestinal podem limitar a disponibilidade de um atleta de elite para treinar e participar de competições importantes. Depois das lesões, as enfermidades (principalmente respiratórias, mas também gastrointestinais) foram a segunda maior razão para um atleta de elite procurar atenção médica tanto durante um treinamento ou enquanto competindo nos Jogos Olímpicos de inverno ou verão. Em um estudo de monitoramento de 3 anos com 322 atletas olímpicos, ~70% das doenças registradas pela equipe médica resultaram em “tempo perdido” (ausência total) dos treinos e competições e o restante das doenças resultaram em “restrições da performance” (menor volume e/ou intensidade de treinos) (Palmer- Green et al., 2013). Claramente, a ausência nos treinamentos causada por enfermidades é incompatível com o sucesso nos esportes de elite que demandam uma grande quantidade de treinos regulares (Tabela 1). Neste contexto, as evidências empíricas mostram que os medalhistas nos principais eventos esportivos, incluindo os Jogos Olímpicos e Campeonatos Mundiais, sofrem menor número de casos de ITRS e episódios com menor duração em comparação com os atletas de menor sucesso em competições nacionais (Hellard et al., 2015; Svendsen et al., 2016).

| Porque as infecções são incompatíveis com o sucesso em esportes de elite. |
|
|
|
|
|
|
|
– Rabdomiólise1 – Miopericardite2 – Insolação no esforço intenso |
Tabela 1. Porque as infecções são incompatíveis com o sucesso em esportes de elite. ITRS = infecção do trato respiratório superior; 1Rabdomiólise = destruição das fibras do tecido muscular que pode levar a falha renal; 2Miopericardite = inflamação aguda do pericárdio geralmente causada por uma infecção.
FATORES DE RISCO PARA INFECÇÕES E IMUNIDADE REDUZIDA EM ATLETAS
Apenas recentemente as pesquisas começaram a delinear o quadro dos fatores de risco relevantes para infecções em atletas de elite (Tabela 2). O conceito de que exercícios intensos diminuem temporariamente a imunidade em atletas era a ideia central da doutrina mais antiga da imunologia do exercício, gerando assim uma abertura para ITRSs e outras infecções. Períodos de exagero e adaptações inadequadas a longo prazo (conhecidos por treinos excessivos) também foram associados com a modulação neuroendócrina, imunidade reduzida e aumento das ITRSs. Esses achados reforçavam a noção prevalecente na época de que o estresse acumulado dos treinos comprometia a saúde imunológica e aumentava o risco para infecções. Então, por muitos anos imunologistas do exercício aceitaram amplamente esta ideia e focaram os esforços de suas pesquisas em neutralizar o exercício intenso como fator de risco relevante para ITRS em atletas. Resumindo, frequentemente se observa que tanto a imunidade inata quanto a adquirida (Figura 1) se encontram transitoriamente reduzidas durante períodos de recuperação após esforço intenso prolongado; normalmente na ordem de 15-70% (Walsh, 2018). Porém tem-se questionado por algum tempo se essas mudanças transitórias na imunidade na presença de exercício pesado agudo e treino intensificado são suficientes para aumentar a susceptibilidade à ITRS de acordo com a teoria da “janela de abertura” (Ekblom et al., 2006). Achados sobre ITRS na maratona de Estocolmo de 2000 forneceram o primeiro grande desafio sobre a teoria da “janela de abertura” não mostrando qualquer aumento nos sintomas de ITRS no pós-corrida. Estes achados contrastam com achados mais antigos que mostram aumento na ITRS após provas de corrida de resistência (Peters & Bateman, 1983). Além disso, observações de Ekblom et al. (2006) apoiam a ideia de que sintomas de ITRS prévios às corridas podem ter sido contabilizados para os relatos de aumento na ITRS após eventos de resistência.

| Dez fatores de risco para infecções em atletas |
|
|
|
|
|
|
|
|
|
|
Tabela 2. Dez fatores de risco para infecções em atletas.
Pesquisas recentes destacam que fatores de risco relevantes para infecções em atletas de elite e equipe militar são em geral similares a aqueles na ampla população (Tabela 2). Fatores de risco incluem a época do inverno (estação de resfriados comuns e influenza), altos níveis de estresse psicológico, ansiedade e depressão, sono insuficiente ou inadequado, e viagens de longa duração (Drew et al., 2017; Hellard et al., 2015; Svendsen et al., 2016; Wentz et al., 2018). Em contraste, o aumento nas cargas dos treinos resultaram em aumento relativamente pequeno na incidência de ITRS e infecções gastrointestinais em um estudo com nadadores de elite (Hellard et al., 2015) e não mostraram mudança na incidência de infecções em um outro estudo com esquiadores cross-country de elite (Svendsen et al., 2016). Baixa disponibilidade de energia tem sido associada com maiores sintomas de doenças em atletas de elite do sexo feminino (Drew et al., 2017). Além das limitações óbvias de que esta observação foi restrita a mulheres, os autores reconheceram a necessidade de mais estudos para avaliar diretamente a disponibilidade de energia (eles utilizaram o questionário LEAF), medidas de desempenho da imunidade e resultados da patologia, esta última para confirmar a infecção. É conhecido que a saúde mental prejudicada (por exemplo, o estresse, a ansiedade e depressão), altamente prevalentes em atletas do sexo feminino em conjunto com a baixa disponibilidade de energia, também exercem papel nos relatos de aumento nas ITRSs. O estresse psicológico, a ansiedade e depressão têm uma importante e bem conhecida influência na imunidade e resistência a infecções (Cohen et al., 1991).
COMO A NUTRIÇÃO INFLUENCIA A IMUNIDADE E A INFECÇÃO?
A habilidade do sistema imune em limpar os vírus, as bactérias e outros patógenos, nomeada de resistência, depende do fornecimento adequado de energia obtida de importantes fontes energéticas, incluindo a glicose, aminoácidos e ácidos graxos. Além das necessidades energéticas, a proliferação celular requer a síntese de DNA e RNA dos nucleotídeos e síntese de proteínas dos aminoácidos. Um fornecimento adequado de aminoácidos também é necessário para a produção de proteínas como as imunoglobulinas, citocinas e proteínas de fase aguda. A influência da restrição severa de todos os nutrientes (Marasmo) e desnutrição energético-proteica (Kwashiorkor) na imunidade e mortalidade relacionada a infecções em países em desenvolvimento é bem documentada (Woodward, 1998). A restrição severa de energia pode também influenciar a imunidade via a ativação do eixo hipotálamo-pituitária-adrenal e aumento dos hormônios do estresse como o cortisol, que é amplamente conhecido por seus efeitos anti-inflamatórios. Os micronutrientes também têm papel importante na síntese de nucleotídeos e ácidos nucleicos (como exemplo, o ferro, zinco e magnésio) e na defesa antioxidante que limita danos aos tecidos (por exemplo, as vitaminas C e E). A disponibilidade de antioxidantes (exemplo, a vitamina C) pode ser particularmente importante durante esforço intenso ou durante infecção quando há o aumento do estresse oxidativo. Alguns micronutrientes podem influenciar diretamente nas funções das células do sistema imune regulando a expressão gênica (por exemplo, a vitamina D).
Existem outros caminhos pelos quais a nutrição pode afetar a imunidade e infecções; por exemplo, os prebióticos e probióticos podem influenciar a imunidade indiretamente modificando a microbiota intestinal, e o zinco elementar (consumidos na forma de drágeas que dissolvem na boca) pode diretamente inibir a atividade viral na região orofaríngea, com efeitos terapêuticos benéficos nas ITRS. Calder (2013) destacou a relação bidirecional entre nutrição, imunidade e infecções. Por um lado, a má nutrição tem influência negativa bem descrita na imunidade e resistência a infecções, mas por outro lado, o aumento amplamente relatado das necessidades energéticas durante a infecção paradoxalmente coincide com o apetite reduzido (anorexia) e má absorção de nutrientes; até o momento, um fenômeno pouco descrito. Pesquisas recentes clareiam este paradoxo mostrando que o apetite reduzido melhora a tolerância imunológica e sobrevivência durante infecção bacteriana porém potencializa a progressão e letalidade de uma infecção viral. (Wang et al., 2016).
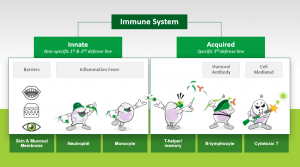
Figura 1
Sistema Imunológico
Imunidade Inata – Não-específica; 1ª e 2ª linha de defesa
Barreiras / Febre por inflamação
Pele e Membrana das Mucosas /Neutrófilos/ Monócitos
Imunidade Adquirida – Específica; 3ª linha de defesa
Anticorpo Humoral / Mediada por Células
Células T auxiliares – Memória/ Linfócitos B/ Linfócito T Citotóxico
Figura 1. Visão geral simples do sistema imunológico. O sistema imunológico fornece uma defesa potente e de várias camadas contra o ataque de microorganismos patogênicos, incluindo vírus, bactérias, fungos e protozoários, e fornece defesa contra o câncer por meio da atividade antitumoral. Os vários elementos celulares e solúveis no arsenal do sistema imunológico contra agentes infecciosos podem ser amplamente divididos em Inatos (não específicos) e Adquiridos (específicos). Ao encontrar um patógeno, a primeira e a segunda linhas de defesa, o sistema imunológico inato é ativado. O sistema imunológico inato compreende barreiras físicas e químicas (por exemplo, pele e membranas mucosas) e fagócitos (por exemplo, neutrófilos, monócitos, etc.) que ingerem e matam microorganismos juntamente com outras células “assassinas” (do inglês natural killers) não específicas. A terceira linha de defesa, o sistema imunológico adquirido, é altamente especializada, mas mais lenta do que o sistema imunológico inato. O sistema imunológico adquirido compreende os linfócitos; especificamente, os linfócitos T e B que proliferam e desempenham várias funções, incluindo a produção de anticorpos de células B, a morte de células T citotóxicas e o desenvolvimento de células de memória T, de modo que uma resposta aumentada possa ser montada na exposição subsequente a patógenos (a base científica descoberta de vacinação de Edward Jenner). Embora subdividir o sistema imunológico em inato e adquirido forneça uma descrição simples, essa distinção é bastante grosseira, pois os sistemas imunológicos inatos e adquiridos estão muito interligados. Por exemplo, os processos de apresentação e reconhecimento de antígenos e exclusão de patógenos exigem que as células do sistema imunológico inato e adquirido trabalhem juntas em harmonia.
UMA NOVA PERSPECTIVA TEÓRICA SOBRE A NUTRIÇÃO E A SAÚDE IMUNOLÓGICA DO ATLETA
Tradicionalmente, os imunologistas têm focado seus esforços em entender o aparato imunológico que se encontra à nossa disposição na batalha contra patógenos infecciosos (resistência). Imunologistas ecológicos preferem um modelo que descreve não apenas a resistência, mas também a tolerância, definida como a habilidade de resistir a um micróbio. Ayres and Schneider (2012) elegantemente descrevem um paradigma utilizando esses conceitos da resistência e da tolerância para melhor entender interações entre humanos e patógenos. Utilizando a metáfora do castelo, eles descrevem os habitantes da fortaleza desempenhando várias atividades cotidianas incluindo reparos nos muros, criando descendentes e providenciando comida. Ao mesmo tempo, estes habitantes precisam decidir quais batalhas valem a luta e quais as armas apropriadas a serem utilizadas; a equivalência imunológica é a de “escolher suas batalhas com sabedoria”. A chave para a tolerância eficiente é a resposta imunológica proporcional: uma resposta imunológica exagerada pode causar danos excessivos aos tecidos e alocar fontes de energia desnecessariamente para longe das funções vitais e ao contrário, uma resposta imunológica fraca aumenta a susceptibilidade aos danos causados pelo patógeno (Figura 2). As espécies reativas de oxigênio (EROs) têm um papel importante na defesa do hospedeiro contra a infecção, mas o aumento no estresse oxidativo durante a resposta imunológica pode resultar em danos colaterais aos tecidos, resultando na maior demanda antioxidante durante a infecção. Trabalhos de referência em abelhas têm demonstrado o custo da ativação imunológica total na sobrevivência do hospedeiro já que a inanição reduziu significativamente o tempo de sobrevivência nas abelhas em atividade imunológica quando comparadas às não ativas imunologicamente. Devido aos danos nos tecidos e o aumento do custo energético durante uma resposta imunológica total, o sistema imune provavelmente evoluiu para controlar infecções persistentes em um nível não prejudicial e apresentar tolerância aos organismos que não apresentam ameaça ao hospedeiro (Figura 2). Um exemplo fundamental são as bactérias mutualísticas que residem no intestino; o sistema imune não desenvolve uma resposta patogênica para combater as “gramas de lipopolissacarídeo” no lúmen intestinal. A homeostase é atingida por um balanço adequado da resistência e da tolerância que nos permitem lutar contra a infecção, onde os sinais indicam que isto é necessário, e ainda manter uma relação saudável com a bactéria mutualística no nosso intestino, por exemplo.
Esta nova perspectiva teórica pode melhorar nosso entendimento do quanto doente iremos nos tornar quando tivermos uma infecção (em termos de severidade e duração), e mais claramente elucidar o papel da nutrição, particularmente em termos de tolerância (Figura 2). É lógico que uma deficiência considerável de um nutriente necessário para a função imunológica apropriada irá diminuir a resistência imunológica e aumentar a susceptibilidade a infecções. Exemplos incluem a influência bem conhecida da deficiência da proteína alimentar na defesa do hospedeiro e mostram que uma deficiência significativa de zinco reduz a imunidade (Calder, 2013). Mas evidências crescentes indicam que para alguns nutrientes existem momentos quando a ingestão acima dos níveis recomendados pode levar a efeitos benéficos na imunidade, provavelmente por otimizar o delicado balanço entre resistência e tolerância. Esta nova perspectiva, ilustrada na Figura 2, gera um enfoque apurado do sistema imunológico em comparação com o cenário confuso anterior dos estudos que investigavam suplementos nutricionais e a saúde imunológica de atletas. Por exemplo, este modelo ajuda a explicar o porquê dos suplementos nutricionais com efeitos tolerogênicos poderem reduzir a carga das infecções em atletas considerados saudáveis (por exemplo, reduziu severidade e duração). Claramente, não é mais suficiente perguntar apenas se uma intervenção nutricional irá impedir um atleta de ficar doente, talvez seja mais pertinente perguntar: a intervenção nutricional irá ajudar a reduzir o quanto doente o atleta irá ficar?
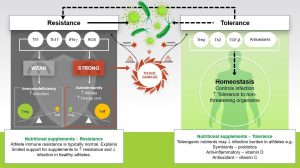
Figura 2
Resistência
Th1/Th17/IFN-γ / EROs
Fraca – Imunodeficiência – ↑ Infecções
Forte – Autoimunidade – ↑ Alergias / ↑ Custo Energético
Treg = T reguladoras / Teff = T efetoras
Suplementos Nutricionais – Resistência
Resistência imunológica do atleta é tipicamente normal. Este fato explica o auxílio limitado dos suplementos para ↑ a resistência e ↓ as infecções em atletas saudáveis.
MAMPS (padrões moleculares associados a patógenos)
Danger = Perigo
Tissue Damage = DANOS AOS TECIDOS
Tolerância
Treg (T reguladoras) / Th2 / TGF-β / Antioxidantes
Homeostase – Controla a infecção ↑ tolerância a organismos que não apresentam ameaça
Suplementos Nutricionais – Tolerância
Nutrientes tolerogênicos podem ↓ a carga da infecção em atletas
Simbióticos – Probióticos
Anti-inflamatórios – Vitamina D
Antioxidante – Vitamina C
Figura 2. Modelo de resistência e tolerância nas interações hospedeiro-patógeno e o valor da suplementação nutricional. A área sombreada escura à esquerda (setas com linhas sólidas) mostra uma visão clássica da resistência imune, onde o armamento imunológico protege o hospedeiro, tentando reduzir a carga de patógenos, através da morte mediada por células e liberação de ERO, por exemplo. A fraca resistência resulta em imunodeficiência e aumento do risco de infecção. Por outro lado, uma resposta imune excessiva a um patógeno causa danos aos tecidos e desvio desnecessário de recursos energéticos para outras funções importantes. Uma resposta imune excessivamente forte está associada à autoimunidade e alergia. Neste modelo simples, a homeostase é alcançada equilibrando os lados efetor e regulador das escalas. Este modelo clássico de homeostase imune negligencia importantes interações tolerogênicas com o patógeno. O conceito de tolerância, a capacidade de suportar micróbios (área sombreada à direita e setas com linhas tracejadas) foi adotado a partir da imunologia ecológica, onde o trabalho em invertebrados mostra importantes interações tolerogênicas entre o hospedeiro e os micróbios, cujos resultados são generalizáveis aos vertebrados. Os patógenos influenciam a magnitude da resposta imune, exibindo moléculas conservadas chamadas Padrões Moleculares Associados a Patógenos (MAMPS) e estimulando a liberação de sinais de perigo de tecidos danificados. A tolerância nesse modelo diminui a atividade de defesa (seta quebrada superior) e ainda controla a infecção em um nível não prejudicial, com o benefício adicional de um custo mais baixo da energia. Isso explica como toleramos bactérias comensais em vez de provocar uma resposta imune para obliterar a grande abundância de bactérias no intestino. Este modelo também ajuda a explicar por que os suplementos nutricionais com efeitos tolerogênicos podem reduzir a carga de infecção (por exemplo, gravidade e duração reduzidas) em atletas saudáveis. Adaptado de Walsh (2019).
IFN-y = interferon gama; ERO = espécies reativas de oxigênio; Teff = células T efetoras; Treg = células T reguladoras.
SUPLEMENTOS NUTRICIONAIS PARA A RESISTÊNCIA IMUNOLÓGICA: “SE NÃO ESTÁ QUEBRADO, NÃO TENTE CONSERTAR!”
A validação do fato de que os suplementos nutricionais para melhorar a resistência imunológica (e ainda a redução da carga do patógeno) vem grande parte de estudos sobre indivíduos com a imunidade prejudicada, como os idosos frágeis e pacientes clínicos, particularmente aqueles apresentando pobre estado nutricional (Bermon et al., 2017). Nos últimos 25 anos aproximadamente, imunologistas do exercício têm pesquisado ativamente sobre os suplementos nutricionais para melhorar a resistência imunológica em atletas (Tabela 3). Durante muito tempo neste período, existia uma ampla aceitação entre os imunologistas do exercício de que a imunidade estava prejudica em atletas com treinos intensos, motivando a busca por intervenções nutricionais. Uma visão mais contemporânea é de que as evidências que apoiam a imunossupressão em atletas são insuficientes. Então, não é de se surpreender com o fato de que os suplementos que visam melhorar a resistência imunológica mostrem poucos benefícios na imunidade de atletas e na defesa do hospedeiro: a frase “se não está quebrado, não tente consertar!” vem à mente (Tabela 3). Uma exceção é o efeito terapêutico de drágeas de zinco no tratamento de resfriados comuns. Um estudo de meta-análise mostrou que dissolver essas drágeas de zinco na boca (75 mg/dia de zinco elementar) reduziu a duração da ITRS em ~3 dias (33%) quando consumida < 24h após o início dos sintomas (Hemila, 2017). O autor aponta que a dosagem ideal de zinco e a composição dos suplementos precisam ser determinadas, já que muitos suplementos de zinco sem necessidade de prescrição médica em farmácias contêm muito pouco zinco ou substâncias que se ligam ao zinco. Apesar da necessidade de elucidação dos exatos mecanismos envolvidos neste processo, o zinco pode atuar como um agente antiviral pelo aumento do interferon gama e redução na fixação do vírus de resfriados comuns em locais de ligação. Os efeitos terapêuticos do zinco no tratamento da ITRS também têm sido atribuídos às propriedades antioxidantes e anti-inflamatórias do zinco elementar e assim as drágeas de zinco também podem ter efeitos tolerogênicos na imunidade.
SUPLEMENTOS NUTRICIONAIS TOLEROGÊNICOS: OS NOVOS ALVOS DE PESQUISAS
A tolerância neste modelo imunológico atenua a atividade de defesa, mas controla efetivamente a infecção em um nível que não causa danos, além de facilitar a regulação homeostática das comunidades benéficas da microbiota intestinal (Figura 2). Por essa perspectiva, é fácil entender por que os estudos envolvendo suplementos nutricionais com propriedades tolerogênicas têm gerado alguns efeitos positivos na redução da carga das infecção em atletas considerados saudáveis (Tabela 4). Os probióticos (e prebióticos) podem apresentar efeitos tolerogênicos influenciando as comunidades da microbiota intestinal e o sistema imunológico da mucosa; os efeitos antioxidantes da vitamina C e os efeitos anti-inflamatórios da vitamina D podem melhorar a tolerância, aliviando o dano aos tecidos durante uma infecção. Como mencionado anteriormente, os efeitos terapêuticos do zinco no tratamento do resfriado comum, apesar de incialmente relacionados ao fato de reduzir o dano do patógeno (melhorando a resistência), podem também ser atribuídos as propriedades antioxidantes e anti-inflamatórias do zinco (tolerogênicas).
PROBIÓTICOS
Os probióticos são microrganismos vivos, que quando administrados regularmente e em quantidades adequadas conferem um benefício para a saúde do hospedeiro modulando as bactérias alojadas no intestino (a microbiota) e a imunidade. Existem vários mecanismos pelos quais os probióticos supostamente beneficiam a imunidade e a resistência a infecções, particularmente as respiratórias e as infecções gastrointestinais; no entanto, até o momento, estes mecanismos não foram claramente elucidados. Os probióticos podem melhorar a resistência imunológica reforçando a barreira intestinal e competindo com os patógenos tanto pela fixação no epitélio intestinal quanto pelos nutrientes disponíveis. Os produtos do metabolismo dos probióticos (como exemplo, o ácido lático) podem também inibir o crescimento dos patógenos no intestino. Considera-se que os probióticos apresentem benefícios mútuos importantes na saúde imunológica que vão além do intestino, já que essas interações entre a comunidade microbiana comensal e o sistema imunológico do hospedeiro ocorrem por meio do sistema imune comum da mucosa. Existe atualmente um amplo consenso de que os probióticos exerçam efeitos anti-inflamatórios e tolerogênicos importantes, mantendo a homeostase (Figura 2). Por exemplo, os probióticos podem prevenir respostas inflamatórias desnecessárias a substâncias estranhas inofensivas no intestino.

| Suplementos Nutricionais para a Resistência Imunológica1 | ||
| Suplemento2 | Mecanismo Proposto | Evidência de Eficácia3 |
| Zinco | O zinco é necessário para a síntese de DNA e é cofator de enzimas para células imunológicas. A RNI é de 7mg/dia para mulheres e 9,5mg/dia para homens. A deficiência de zinco resulta em imunidade prejudicada (por exemplo, atrofia linfoide) e a deficiência de zinco não é incomum em atletas.
Efeito antiviral das drágeas de zinco. |
Sem dados que comprovem “prevenção de ITRS”. Alta dosagem de zinco regularmente pode diminuir a função imune e deve ser evitada.
Forte evidência para tratamento de ITRS. Dissolver drágeas de zinco na boca (75mg/dia de zinco elementar) encurta resfriados comuns em ~33%, o zinco precisa ser ingerido <24hrs após o início da ITRS. Composição e dosagem ideal das drágeas de zinco a serem determinadas. Efeitos colaterais incluem gosto ruim e náusea. |
| Glutamina | Aminoácido não essencial que é um importante substrato energético para as células imunológicas, particularmente linfócitos. A glutamina circulante é reduzida após exercício prolongado e treinos muito intensos. | Dados de comprovação escassos. Algumas evidências de incidência menor de ITRS após eventos de resistência em competições, após recebimento de suplementação de glutamina (2x 5g). Mecanismo para efeito terapêutico necessita de investigação. Suplementação antes e depois do exercício não altera a função imunológica. |
| Carboidratos | Mantém açúcar sanguíneo durante o exercício, diminui hormônios do estresse e ainda atenua perturbações imunológicas. | Dados de comprovação escassos. Ingestão de carboidratos (30-60g/h) atenua hormônios do estresse e algumas, mas não todas, perturbações imunológicas durante o exercício. Evidência muito limitada de que possa modificar o risco de infecção em atletas. |
| Colostro bovino | Primeiro leite proveniente da vaca, que contém anticorpos, fatores de crescimento e citocinas. Relatada melhora na imunidade da mucosa e aumento da resistência a infecções. | Dados de comprovação escassos de que o colostro bovino neutralize a redução na imunidade da mucosa e imunidade in-vivo após exercício intenso. Algumas evidências em um pequeno número de participantes de que o colostro bovino diminua a incidência de ITRS. Dados futuros para suporte são necessários. |
| Β-Glucanas | Polissacarídeos provenientes da parede celular de fermentos, fungos, algas e aveias que estimulam a imunologia inata. | Dados de comprovação escassos. Efetivo em ratos inoculados com vírus da influenza, no entanto, estudos com atletas não mostraram benefícios para a imunidade e achados foram equivocados para risco de ITRS. |
| Echinacea | Extrato herbal relatado na melhora da imunidade via efeitos estimulantes nos macrófagos. Há algumas evidências in-vitro para este fato. | Dados de comprovação escassos. Pequena redução na incidência de ITRS, mas sem influência na duração da ITRS na população em geral. Achados ambíguos de um pequeno número de estudos em atletas. Dados futuros para suporte são necessários. |
| Cafeína | Estimulante encontrado em uma variedade de alimentos e bebidas (café e bebidas esportivas). A cafeína é um antagonista de receptor de adenosina e células imunológicas expressam receptores de adenosina. | Dados de comprovação escassos. Evidências mostram que a suplementação com cafeína ativa os linfócitos e atenua a queda na função dos neutrófilos após o exercício. Eficácia para alteração do risco para ITRS em atletas permanece incerta. |
Tabela 3. Suplementos nutricionais e resistência imunológica 1 em atletas. Mecanismo de ação proposto e evidência de eficácia. Adaptado de Walsh (2019). ITRS = Infecção do trato respiratório superior. RNI = Ingestão recomendada de nutrientes. 1 A resistência reduz a carga do patógeno, o sistema imunológico protege o hospedeiro. 2 Suplementos precisam vir de fonte confiável e testados por programa confiável de garantia de qualidade (Maughan et al., 2018). 3Leitores devem acessar a declaração de consenso da Sociedade Internacional de Imunologia do Exercício para futura discussão sobre evidência de eficácia destes suplementos (Bermon et al., 2017).

| Suplementação Nutricional para Melhorar a Tolerância1 Imunológica | ||
| Suplemento | Mecanismo Proposto | Evidência de Eficácia |
| Probióticos | Micro-organismos vivos que quando administrados oralmente por diversas semanas podem aumentar o número de bactérias benéficas do intestino. Associados com uma gama de potenciais benefícios para a saúde intestinal e efeitos tolerogênicos. Prebióticos são tipicamente carboidratos não-digeríveis que aumentam a comunidade de bactérias benéficas no intestino. | Dados com comprovação moderada-forte em atletas com doses diárias de ~1010 bactérias vivas. Meta-análise mostra ~50% de redução na incidência de ITRS e ~2 dias de redução na duração da ITRS. Não está claro se os probióticos podem reduzir o estresse gastrointestinal e infecção, exemplo na diarreia do viajante. Dados de suporte limitados para probióticos na redução do risco de ITRS em atletas. |
| Vitamina C | Uma vitamina antioxidante essencial solúvel em água que extingue EROs. Ingestão diária recomendada para adultos é de 90mg para homens e 75mg para mulheres (EUA). | Dados de suporte fortes para “prevenção de ITRS” em atletas. Meta análise mostra ~50% da redução da incidência de ITRS quando se toma vitamina C (0,25-1,0g/dia). Sem relato de efeitos colaterais. No entanto, não está claro se antioxidantes neutralizam a adaptação aos treinos em indivíduos bem treinados.
Altas doses de vitamina C (doses em gramas) provavelmente necessárias se a suplementação começar após o início da ITRS para compensar a resposta inflamatória aumentada. Altas doses de vitamina C durante ITRS têm sido relatadas na redução da duração da ITRS. Futuras pesquisas são necessárias. |
| Vitamina D | Vitamina essencial anti-inflamatória e solúvel em óleo conhecida por influenciar diferentes aspectos da imunidade (exemplo, expressão de proteínas antimicrobianas). Exposição da pele à luz do sol é responsável por 90% da fonte anual de vitamina D. RNI de 5-15µ/dia. | Dados de suporte moderados-fortes. Evidências de deficiência em atletas e soldados especialmente no inverno (redução da exposição solar da pele). Deficiência tem sido associada com risco aumentado de ITRS. Meta-análise mostra alguns benefícios da suplementação na redução da incidência de ITRS. Recomenda-se monitoramento e 1.000UI/dia D3 no outono-inverno para manter a suficiência quando necessário. Risco aumentado de resultados adversos quando a suplementação for >4.000UI/dia de vitamina D.2 |
| Polifenóis, exemplo Quercetina | Flavonoide das plantas. Estudos in-vitro mostram fortes efeitos anti-inflamatórios, antioxidantes e antipatógenos. | Dados de suporte baixos-moderados. Algumas evidências na redução da incidência de ITRS durante curtos períodos de treinos intensificados, no entanto, em um pequeno número de indivíduos não treinados. Pouca influência em marcadores imunológicos. Suposto efeito antiviral para a Quercetina. Futuras pesquisas são necessárias. |
| Omega-3, PUFAs | Encontrado no óleo de peixe. Relatado exercer efeito anti-inflamatório pós-exercício regulando formação eicosanoide, por exemplo prostaglandinas. A prostaglandina é imunossupressora. | Dados de suporte limitados para atenuação da inflamação e mudanças funcionais após danos aos músculos pelo exercício em humanos e nenhuma evidência de redução de risco de ITRS em atletas. Algumas evidências de que o estresse oxidativo na verdade aumentou em atletas com suplementação de n-3 PUFA. |
| Vitamina E | Vitamina essencial solúvel em óleo que extingue com EROs induzidas pelo exercício. | Sem dados de suporte em atletas. Melhorou imunidade in-vivo e reduziu a incidência de ITRS em idosos frágeis, mas não apresentou benefícios em adultos jovens saudáveis. Um estudo na verdade mostrou que a suplementação com vitamina E (e o B-caroteno) aumentou o risco para ITRS naqueles que realizam exercício intenso. Altas doses podem até ser pró-oxidantes. |
Tabela 4. Suplementação Nutricional para Melhorar a Tolerância1 Imunológica em Atletas: mecanismos de ação propostos e evidência de eficácia. Adaptado de Walsh (2019). ITRS = Infecção do trato respiratório superior. RNI = Ingestão recomendada de nutrientes. ERO = Espécie reativa de oxigênio. PUFA = Ácido graxo poli-insaturado. 1Tolerância atenua a atividade de defesa e ainda assim controla a infecção num nível não prejudicial. 2Suplementos precisam vir de fonte confiável e testados por programa confiável de garantia de qualidade (Maughan et al., 2018). 3Leitores devem acessar a declaração de consenso da Sociedade Internacional de Imunologia do Exercício para futura discussão sobre evidência de eficácia destes suplementos (Bermon et al., 2017).
Os resultados dos estudos que investigam a influência dos probióticos na saúde imunológica de atletas são promissores e têm sido extensamente revisados por toda a parte (Pyne et al., 2015). Um teste controlado por placebo, crossover em 20 corredores (de distâncias) de elite mostrou que a suplementação com probióticos (Lactobacillus fermentum) por 28 dias reduziu o número de dias da ITRS e a severidades dos sintomas (Cox et al., 2010). Outro teste randomizado, controlado por placebo em 64 atletas de universidades relatou uma incidência menor da ITRS durante período de treinamento de inverno por 4 meses em atletas recebendo probiótico diário (Lactobacillus casei Shirota) em comparação com o placebo (Gleeson et al., 2011). Este estudo também relatou melhor manutenção da secreção das imunoglobulinas A pela saliva (SIgA) no grupo probiótico. A suplementação por 4 semanas com fórmula com múltiplas espécies de probióticos (Lactobacillus, Bifidobacterium and Streptococcus) reduziu os marcadores da permeabilidade intestinal e sintomas de desconforto gastrointestinal durante estresse causado pela temperatura durante exercício (Shing et al., 2014). Ainda é incerto se probióticos e prebióticos podem prevenir a diarreia do viajante, já que a profilaxia neste quadro pode ser dependente da variedade de probiótico fornecida. Apesar disto, resultados de estudos com a população em geral mostram alguns efeitos benéficos dos probióticos na ITRS (Tabela 4). Uma meta-análise recente mostrou que a suplementação com probióticos reduziu a incidência da ITRS em ~50%, encurtou a duração da ITRS em ~2 dias, reduziu a taxa de prescrições de antibióticos e resultou em apenas alguns efeitos colaterais pequenos (Hao et al., 2015). No entanto, apenas 12 estudos foram incluídos na meta-análise (n=3,720) e a qualidade da evidência foi considerada baixa. Limitações incluíram o tamanho relativamente pequeno das amostras, controles pobres e procedimentos incertos na randomização. Apesar da falta da disponibilidade de evidências definitivas apoiando os efeitos dos probióticos na redução da carga das infecções em atletas, estudos recentes mostram alguns benefícios e pouca evidência de danos. Atletas podem, portanto, considerar a suplementação de probióticos particularmente durante os períodos de maior risco de ITRS, como nas semanas anteriores e durante viagens internacionais (Pyne et al., 2015).
VITAMINA C
A vitamina C (ácido ascórbico) é o antioxidante solúvel em água mais efetivo em vasculhar EROs tanto em fluidos intracelulares como extracelulares. Boas fontes de vitamina C incluem frutas e hortaliças e a ingestão diária recomendada para adultos é de 90mg para homens e 75mg para mulheres (EUA). A vitamina C é encontrada em altas concentrações nos leucócitos, mas os níveis caem drasticamente durante um resfriado comum quando existe aumento do estresse oxidativo. Sendo assim, há uma base científica segura para a suplementação de vitamina C na melhora da tolerância por atenuar os danos aos tecidos durante uma infecção (Ayres & Schneider, 2012). Também existe uma lógica para os benefícios antecipados na redução da ITRS em atletas que passam por estresse oxidativo durante exercícios intensos. Uma meta-análise examinou a evidência de que doses diárias de vitamina C com mais de 200mg têm efeitos profiláticos e terapêuticos no resfriado comum (Hemila & Chalker, 2013). Em um subgrupo com 5 testes controlados com placebo em praticantes de exercícios intensos (n=598), incluindo maratonistas, esquiadores e soldados, a vitamina C (0,25–1,0 g/dia) reduziu a incidência da ITRS em 52%. Por exemplo, em um estudo com desenho duplo-cego, controlado por placebo, Peters et al. (1993) mostrou que 600 mg/dia de vitamina C por 3 semanas anteriormente a ultramaratona de 90km reduziu a incidência dos sintomas da ITRS nas duas semanas posteriores a corrida (33% vs. 68% em corredores controle agrupados por idade e sexo). Se os benefícios da vitamina C observados na prevenção dos sintomas da ITRS nestes indivíduos sob exercício intenso representam um real decréscimo na infecção respiratória viral é um importante caminho para se investigar. As incidências relativamente altas dos sintomas de ITRS neste estudo (68% no placebo) e os benefícios observados da vitamina C podem estar relacionados com a indução da bronco-constrição pelo exercício causada pela inflamação das vias respiratórias e danos, que são comuns durante o exercício intenso. Apesar dos mecanismos, existem benefícios claros da suplementação da vitamina C (0,25–1,0 g/dia) na redução dos sintomas da ITRS em atletas (Tabela 4).
Determinar se o início da suplementação com vitamina C depois do começo da ITRS tem efeitos terapêuticos é complicado pelas diferenças metodológicas entre os estudos, incluindo diferenças nos momentos do início da suplementação com vitamina C e na duração e dosagem da suplementação (Tabela 4). Hemila and Chalker (2013) sugerem que doses diárias maiores de vitamina C podem ser necessárias para tratar a ITRS e que testes terapêuticos futuros em adultos deveriam utilizar dosagens que ultrapassem 8g/dia de vitamina C. Outra incerteza é se a suplementação com altas doses regulares de vitamina C (1g/dia) pode neutralizar algumas das adaptações aos treinos de resistência. Os autores de um estudo pediram cautela com a suplementação de altas doses de antioxidantes durante treinos de resistência para evitar a neutralização de adaptações celulares (Paulsen et al., 2014). Porém permanece incerto se a suplementação com altas doses de antioxidantes realmente anula essas adaptações aos treinos em atletas altamente treinados. Já que a suplementação com vitamina C (0,25–1,0 g/dia) é barata, segura e pode prevenir os sintomas de ITRS em indivíduos com treinos intensos, atletas deveriam considerar a suplementação com vitamina C durante períodos de risco aumentado de infecções, como por exemplo em viagens ao exterior para competições importantes.
VITAMINA D
Em 1981, o médico inglês e conhecido epidemiologista, R. Edgar Hope-Simpson foi o primeiro a levantar hipóteses de que as infecções respiratórias virais (por exemplo, a influenza epidêmica) têm um estímulo sazonal intimamente associado com a radiação solar. A natureza deste “estímulo sazonal” permaneceu desconhecida até que efeitos imunomodulatórios importantes da vitamina D secosteróide dependente da luz solar foram totalmente reconhecidos (Berry et al., 2011). A produção da vitamina D como resultado da radiação da luz solar ultravioleta (UV)B na pele tipicamente fornece 80%–100% das necessidades corporais de vitamina D, com uma quantidade pequena sendo proveniente da dieta (boas fontes incluem peixes gordos e gemas de ovos). A recomendação diária da ingestão dietética de vitamina D para adultos (5 μg ou 200 IU na União Europeia e 15 μg ou 600 IU nos Estados Unidos) leva em consideração que não ocorre síntese e que toda vitamina D em uma pessoa vem da ingestão dietética, apesar de que isto irá raramente acontecer na prática. Está claro atualmente que a vitamina D tem papeis importantes além de seus bem conhecidos efeitos na homeostase do cálcio e ossos. Células imunológicas expressam receptores de vitamina D, incluindo antígenos apresentadores de células, células T e células B, e estas células são todas capazes de sintetizarem o metabólito biologicamente ativo da vitamina D, a 1, 25 hidroxivitamina D. É bem aceito hoje em dia que a vitamina D exerce um papel importante na melhora da imunidade inata e pela indução de proteínas antimicrobianas, ainda assim muitas das ações da vitamina D na imunidade adquirida são de natureza anti-inflamatória. Efeitos tolerogênicos da vitamina D (Figura 2) previnem respostas imunológicas exageradas seguidas da ativação das células T (por exemplo, 1, 25 hidroxivitamina D induz o desenvolvimento das células T regulatórias e inibe a produção do interferon gama) (He et al., 2016). Tem existido um crescente interesse nos benefícios da suplementação com vitamina D já que estudos mostram insuficiência de vitamina D (circulante 25(OH)D < 50 nmol/L) em mais de metade de todos os atletas e equipe militar testados durante o inverno, quando a luz solar UVB na pele é insignificante (Carswell et al., 2018; Close et al., 2013). A evidência impressionante apoia que é necessário evitar a deficiência de vitamina D (circulante 25(OH)D < 30 nmol/L) para manter a imunidade e reduzir a carga da ITRS na população em geral, atletas e equipe militar (He et al., 2016). Uma meta-análise recente relatou efeitos protetores da vitamina D oral nas infecções respiratórias (razão de possibilidades “odds ratio” 0,88), particularmente em indivíduos deficientes de vitamina D de acordo com os critérios de referência (“odds ratio” 0,30) e naqueles que receberam vitamina D oral diariamente ou semanalmente, mas não naqueles que receberam uma ou mais doses únicas altas (Martineau et al., 2017). A suficiência de vitamina D pode ser atingida por exposição segura ao sol no verão e no inverno quando triagens mostram insuficiência, com 1.000 IU/dia de suplementação de vitamina D3 (Tabela 4) (Carswell et al., 2018).
RESUMO
Esta revisão fornece uma nova perspectiva teórica de como a nutrição influencia a saúde imunológica do atleta. Um paradigma adotado da imunologia ecológica é apresentado e inclui a resistência imunológica (a habilidade de destruir micróbios) e a tolerância imunológica ( habilidade de atenuar a resposta imunológica e controlar a infecção em um nível não prejudicial). Através desta perspectiva, é fácil enxergar porque os estudos investigando os suplementos nutricionais que visam a melhora da resistência imunológica em atletas mostram benefícios limitados: as evidências que comprovam a supressão imunológica em atletas são escassas; sendo assim, se não está quebrado, não tente consertar! Esta nova perspectiva aprimora o foco nos suplementos nutricionais com propriedades tolerogênicas benéficas que reduzem a carga das infecções em atletas considerados saudáveis, incluindo probióticos, vitamina C e vitamina D. Pesquisas futuras são necessárias para demonstrar os benefícios dos possíveis suplementos nutricionais tolerogênicos para reduzir a carga das infecções em atletas, sem anular as adaptações aos treinos e sem efeitos colaterais. Quando se considerar a suplementação nutricional, os atletas devem checar se o suplemento é de fonte confiável e se é testado por programa confiável de garantia de qualidade (Maughan et al., 2018). Finalmente, para limitar a carga das infecções e manter a saúde imunológica, atletas devem seguir as recomendações práticas da tabela 5.
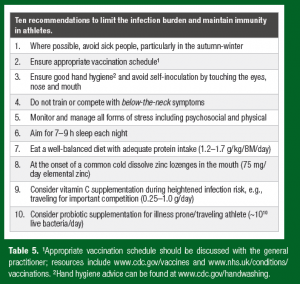
| Dez recomendações para limitar a carga de infecções e manter a imunidade em atletas |
|
|
|
|
|
|
|
|
|
|
Tabela 5. 1Calendário de vacinação apropriado deve ser discutido com o clínico geral; 2 Aconselhamento sobre higiene das mãos pode ser encontrado em www.cdc.gov/handwashing.
REFERÊNCIAS
Ayres, J.S., and D.S. Schneider (2012). Tolerance of infections. Annu. Rev. Immunol. 30:271-294.
Bermon, S., L.M. Castell, P.C. Calder, N.C. Bishop, E. Blomstrand, F.C. Mooren, K. Kruger, A.N.Kavazis, J.C. Quindry, D.S. Senchina, D.C. Nieman, M. Gleeson, D.B. Pyne, C.M. Kitic, G.L.Close, D.E. Larson-Meyer, A. Marcos, S.N. Meydani, D. Wu, N.P. Walsh, and R. Nagatomi(2017). Consensus Statement Immunonutrition and Exercise. Exerc. Immunol. Rev. 23:8-50.
Berry, D.J., K. Hesketh, C. Power, and E. Hypponen (2011). Vitamin D status has a linear associationwith seasonal infections and lung function in British adults. Br. J. Nutr. 106:1433-1440.
Calder, P.C. (2013). Feeding the immune system. Proc. Nutr. Soc. 72:299-309.
Carswell, A.T., S.J. Oliver, L.M. Wentz, D.S. Kashi, R. Roberts, J.C.Y. Tang, R.M. Izard, S. Jackson,D. Allan, L.E. Rhodes, W.D. Fraser, J.P. Greeves, and N.P. Walsh (2018). Influence of vitaminD supplementation by sunlight or oral D3 on exercise performance. Med. Sci. Sports Exerc.50:2555-2564.
Close, G.L., J. Russell, J.N. Cobley, D.J. Owens, G. Wilson, W. Gregson, W.D. Fraser, and J.P.Morton (2013). Assessment of vitamin D concentration in non-supplemented professionalathletes and healthy adults dITRSng the winter months in the UK: implications for skeletalmuscle function. J. Sports Sci. 31:344-353.
Cohen, S., D.A. Tyrrell, and A.P. Smith (1991). Psychological stress and susceptibility to thecommon cold. N. Engl. J. Med. 325:606-612.
Cox, A.J., D.B. Pyne, P.U. Saunders, and P.A. Fricker (2010). Oral administration of the probioticLactobacillus fermentum VRI-003 and mucosal immunity in endurance athletes. Br. J. SportsMed. 44:222-226.
Drew, M.K., N. Vlahovich, D. Hughes, R. Appaneal, K. Peterson, L. Burke, B. Lundy, M. Toomey, D.Watts, G. Lovell, S. Praet, S. Halson, C. Colbey, S. Manzanero, M. Welvaert, N. West, D.B.Pyne, and G. Waddington (2017). A multifactorial evaluation of illness risk factors in athletespreparing for the Summer Olympic Games. J. Sci. Med. Sport 20:745-750.
Ekblom, B., O. Ekblom, and C. Malm (2006). Infectious episodes before and after a marathon race.Scand. J. Med. Sci. Sports 16:287-293.
Gleeson, M., N.C. Bishop, M. Oliveira, and P. Tauler (2011). Daily probiotic’s (Lactobacillus caseiShirota) reduction of infection incidence in athletes. Int. J. Sport Nutr. Exerc. Metab. 21:55-64.
Hao, Q., B.R. Dong, and T. Wu (2015). Probiotics for preventing acute upper respiratory tractinfections. Cochrane Database Syst. Rev.:CD006895.
He, C.S., X.H. Aw Yong, N.P. Walsh, and M. Gleeson (2016). Is there an optimal vitamin D status forimmunity in athletes and military personnel? Exerc. Immunol. Rev. 22:42-64.
Hellard, P., M. Avalos, F. Guimaraes, J.F. Toussaint, and D.B. Pyne (2015). Training-related risk ofcommon illnesses in elite swimmers over a 4-yr period. Med. Sci. Sports Exerc. 47:698-707.
Hemila, H. (2017). Zinc lozenges and the common cold: a meta-analysis comparing zinc acetateand zinc gluconate, and the role of zinc dosage. J.R. Soc. Med. Open 8:2054270417694291.
Hemila, H., and E. Chalker (2013). Vitamin C for preventing and treating the common cold. Cochrane Database Syst. Rev.:CD000980.
Martineau, A.R., D.A. Jolliffe, R.L. Hooper, L. Greenberg, J.F. Aloia, P. Bergman, G. Dubnov-Raz, S.Esposito, D. Ganmaa, A.A. Ginde, E.C. Goodall, C.C. Grant, C.J. Griffiths, W. Janssens, I.Laaksi, S. Manaseki-Holland, D. Mauger, D.R. Murdoch, R. Neale, J.R. Rees, S. Simpson Jr.,I. Stelmach, G.T. Kumar, M. Urashima, and C.A. Camargo Jr. (2017). Vitamin Dsupplementation to prevent acute respiratory tract infections: systematic review and metaanalysisof individual participant data. Brit. Med. J. 356:i6583.
Maughan, R.J., L.M. Burke, J. Dvorak, D.E. Larson-Meyer, P. Peeling, S.M. Phillips, E.S. Rawson,N.P. Walsh, I. Garthe, H. Geyer, R. Meeusen, L.J.C. van Loon, S.M. Shirreffs, L.L. Spriet, M.Stuart, A. Vernec, K. Currell, V.M. Ali, R.G. Budgett, A. Ljungqvist, M. Mountjoy, Y.P. Pitsiladis,T. Soligard, U. Erdener, and L. Engebretsen (2018). IOC consensus statement: dietarysupplements and the high-performance athlete. Br. J. Sports Med. 52:439-455.
Palmer-Green, D., C. Fuller, R. Jaques, and G. Hunter (2013). The Injury/illness performanceproject (IIPP): a novel epidemiological approach for recording the consequences of sportsinjITRSes and illnesses. J. Sports Med. 2013:523974.
Paulsen, G., K.T. Cumming, G. Holden, J. Hallen, B.R. Ronnestad, O. Sveen, A. Skaug, I. Paur, N.E.Bastani, H.N. Ostgaard, C. Buer, M. Midttun, F. Freuchen, H. Wiig, E.T. Ulseth, I. Garthe, R.Blomhoff, H.B. Benestad, and T. Raastad (2014). Vitamin C and E supplementation hamperscellular adaptation to endurance training in humans: a double-blind, randomised, controlledtrial. J. Physiol. 592:1887-1901.
Peters, E.M., and E.D. Bateman (1983). Ultramarathon running and upper respiratory tractinfections. An epidemiological survey. S. Afr. Med. J. 64:582-584.
Peters, E.M., J.M. Goetzsche, B. Grobbelaar, and T.D. Noakes (1993). Vitamin C supplementationreduces the incidence of postrace symptoms of upper-respiratory-tract infection inultramarathon runners. Am. J. Clin. Nutr. 57:170-174.
Pyne, D.B., N.P. West, A.J. Cox, and A.W. Cripps (2015). Probiotics supplementation for athletes -clinical and physiological effects. Eur. J. Sport Sci. 15:63-72.
Shing, C.M., J.M. Peake, C.L. Lim, D. Briskey, N.P. Walsh, M.B. Fortes, K.D. Ahuja, and L. Vitetta(2014). Effects of probiotics supplementation on gastrointestinal permeability, inflammationand exercise performance in the heat. Eur. J. Appl. Physiol. 114:93-103.
Svendsen, I.S., I.M. Taylor, E. Tonnessen, R. Bahr, and M. Gleeson (2016). Training-related andcompetition-related risk factors for respiratory tract and gastrointestinal infections in elitecross-country skiers. Br. J. Sports Med. 50:809-815.
Walsh, N.P. (2018). Recommendations to maintain immune health in athletes. Eur. J. Sport Sci.18:820-831.
Walsh, N.P. (2019). Nutrition and athlete immune health: new perspectives on an old paradigm.Sports Med. In press.
Wang, A., S.C. Huen, H.H. Luan, S. Yu, C. Zhang, J.D. Gallezot, C.J. Booth, and R. Medzhitov(2016). Opposing effects of fasting metabolism on tissue tolerance in bacterial and viralinflammation. Cell 166:1512-1525 e12.
Wentz, L.M., M.D. Ward, C. Potter, S.J. Oliver, S. Jackson, R.M. Izard, J.P. Greeves, and N.P. Walsh(2018). Increased risk of upper respiratory infection in military recruits who report sleeping less than 6 h per night. Mil. Med. 183:e699-e704.
Woodward, B. (1998). Protein, calories, and immune defenses. Nutr. Rev. 56:S84-S92.






