SSE #201: NUTRIÇÃO E SAÚDE ÓSSEA DO ATLETA
PONTOS CHAVE:
- Atletas precisam ter mais atenção com a saúde óssea a curto prazo, para reduzir os riscos de lesões, e a longo prazo quando estiverem aposentados do esporte.
- A dieta geral necessitada pelo atleta para auxiliar a saúde dos ossos não é significativamente diferente da dieta necessitada pela população em geral.
- No entanto, não está claro se as recomendações nutricionais para a população em geral são suficientes para compensar qualquer deficiência ou insuficiência nos atletas. Por exemplo, não é conhecido qual seria a ingestão ideal de vários micronutrientes para auxiliar o atleta em seus treinos pesados e competições.
- Se os atletas não atingirem a ingestão suficiente de certos nutrientes importantes para a saúde óssea, ou se as preferências alimentares e/ou prevenção a intolerâncias limitarem o consumo de nutrientes, os atletas e médicos esportivos podem considerar alimentos fortificados ou suplementos (considerando totalmente os aspectos de segurança em caso de suplementação).
- Existem algumas questões específicas pertinentes aos atletas incluindo, mas não necessariamente se limitando a disponibilidade energética, baixa disponibilidade de carboidratos, ingestão de proteínas, ingestão de vitamina D, e perdas de cálcio e sódio pelo suor. No entanto, pesquisas adicionais específicas sobre atletas são necessárias.
INTRODUÇÃO
O que é saúde óssea do atleta? Geralmente, isso se relaciona com dois principais fatores, o primeiro fator na mente de atletas e/ou técnicos é evitar ao máximo uma lesão ou ferimento, porque este é um perigo imediato para os resultados de desempenho. Fratura por estresse é a causa mais comum de lesões ósseas sofridas por atletas; ocorrendo com relativa regularidade em muitos esportes, e sendo causada pela aplicação rítmica e repetitiva de carga mecânica de maneira sublimiar (McBryde, 1985). Sendo estas lesões causadas pela utilização excessiva, treinos de alta intensidade e frequência onde os atletas têm a carga do próprio peso corporal, o risco de desenvolver fraturas por estresse aumenta significativamente (Fredericson et al., 2007). Elas são lesões significativas, e o tempo de treinamento perdido como resultado pode ser prolongado (Ranson et al., 2010). A fisiologia patológica de lesões de fraturas por estresse é complexa e não entendida por completo, mas alguns estudos têm sugerido que inadequações nutricionais poderiam ser consideradas fator de risco (Moran et al., 2012).
Além do risco de lesão, existe, pelo menos em alguns esportes um risco a longo prazo para a saúde óssea e a prevenção da osteopenia e osteoporose deve ser considerada, particularmente quando a massa óssea já é considerada baixa no atleta durante a fase inicial da vida adulta. Isso é particularmente pertinente dado que aproximadamente 90% do pico de massa óssea é adquirida aos 20 e poucos anos de vida do atleta. Na verdade, a quantidade de massa óssea (também conhecida como densidade mineral óssea DMO) adquirida quando o atleta estiver com 30 anos de idade é provavelmente a maior que ele poderá atingir durante toda a sua vida. Isto dito, seria errado apenas considerar a saúde óssea nestes termos. Não é apenas a massa óssea que é importante, mas também a força dos ossos (que está relacionada com a habilidade de resistir à pressão colocada sobre eles), incluindo sua geometria e microarquitetura óssea (independentemente relacionada a estrutura cortical e trabecular do osso). As consequências da saúde óssea pobre na vida mais tarde são significativas, e por toda a Europa, as taxas de fraturas advindas da osteoporose são altas (Hernlund et al., 2013). A Osteoporose afeta significativamente não apenas a qualidade de vida de um indivíduo, mas também o tempo de vida; por exemplo, um quinto dos indivíduos que necessitam de hospitalização por fraturas devido a fragilidade morrem em um período de 6 meses (Instituto Nacional para a Saúde e Excelência Clínica, 2012).
Determinar a saúde óssea a longo prazo em atletas não é necessariamente simples, já que não existem dados abrangentes relacionados ao número de ex-atletas que sofrem de osteopenia ou osteoporose em idade mais avançada. Adicionalmente, poderia se questionar se faz sentido comparar dados de atletas com os dados da população normal, utilizando o T-Score (que compara quanto a massa óssea de um indivíduo desvia da massa óssea de um adulto com 30 anos de idade na média) ou o Z-Score (que compara a massa óssea média das pessoas da mesma idade e sexo). A razão para isso é que muitos atletas seriam considerados menores (por exemplo, corredores e jóqueis), ou maiores (por exemplo, jogadores de rugby), que a média individual e então essa comparação com a população em geral poderia ser equivocada.
NUTRIÇÃO E SAÚDE ÓSSEA
Está claro que o osso pode ser influenciado pela dieta e nutrição durante o tempo de uma vida (Mitchell et al., 2015), já que o turnover ósseo tende a ser reduzido com a alimentação quando em comparação ao jejum (Clowes et al., 2002). Quando indivíduos são alimentados, ambas as taxas de formação óssea (ganho) e, provavelmente em maior extensão a reabsorção óssea (perda), diminuem acentuadamente (para fonte deste tópico veja: Walsh e Henriksen, 2010). Isto pode ser explicado pelo fato de que a alimentação influencia alguns hormônios (como hormônios calciotrópicos, hormônios como as incretinas, hormônio do crescimento e o cortisol) que por sua vez ajudam a regular o turnover ósseo.
Enquanto é importante saber que o tecido ósseo pode ser influenciado pela alimentação ou jejum, é também tão importante de uma visão prática saber quais nutrientes auxiliam o esqueleto e se os atletas têm demandas nutricionais ósseas que diferem de indivíduos não atletas. Cogita-se que as necessidades nutricionais para o esqueleto em crescimento e envelhecimento de atletas não seriam tão diferentes da população em geral. A Tabela 1 destaca alguns dos nutrientes chave que auxiliam o desenvolvimento ósseo saudável (sucintamente resumida por Palacios, 2006). O que permanece a ser determinado é se o treino prolongado com exercícios pesados, frequentemente realizado por muitos atletas, aumenta as necessidades de certos nutrientes em quantidades maiores do que as recomendadas para população em geral (por exemplo, veja as diretrizes do Conselho de Pesquisas Médicas e Autoridade Nacional em Segurança Alimentar Europeia, e a Academia Nacional de Medicina). Questão para futuras considerações dos atletas, técnicos e médicos esportivos, é o fato de que a quantidade recomendada de ingestão foca em garantir que a maioria da população não seja deficiente de um nutriente em particular ao invés de tentar otimizar as funções biológicas, o que é uma das principais preocupações do atleta (Larson-Meyer et al., 2018).
Sendo assim, consultas com um nutricionista qualificado em performance ou nutrição esportiva é aconselhável para que seja realizada uma avaliação nutricional bem conduzida relacionada à saúde óssea. Mais especificamente, deve ser dada atenção particular ao consumo de laticínios, peixes, frutas e hortaliças (especialmente do tipo de folhas verdes) já que esses são os nutrientes mais comumente citados no auxílio a saúde óssea. O atleta, assim como o resto da população, terá preferências alimentares e intolerâncias que podem prevenir ou limitar a ingestão de certos nutrientes que são importantes à saúde óssea. Sob estas circunstâncias, o atleta (com o aconselhamento e recomendação de um médico especialista) deve considerar alimentos fortificados ou suplementos, especialmente caso alguma deficiência ou insuficiência tenha sido identificada através de exames .
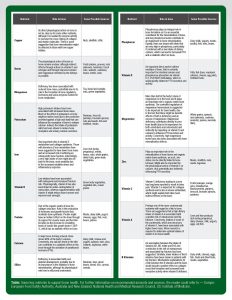
Tabela 1
| Nutriente | Papel nos ossos | Algumas Possíveis Fontes |
| Cobre | Sua ação fisiológica direta nos ossos não está clara, como em outros nutrientes, apesar de ser necessário para atividade enzimática para aumentar o crosslinking de moléculas de colágeno e elastina. Existem sugestões de que a mineralização óssea poderia ser afetada naqueles com baixa ingestão de cobre. | Castanhas, mariscos, miúdos |
| Boro | A ação fisiológica do boro nos ossos permanece incerta, apesar de efeitos indiretos por meio de ações na vitamina D e estrógeno, para melhor retenção de cálcio e magnésio pelos rins ser possível. | Frutas (uva passa, ameixa seca), castanhas (amêndoas, nozes, castanha do Pará, avelãs, castanha de caju), feijões, lentilha, vinho. |
| Manganês | Deficiência tem sido associada a massa óssea reduzida, potencialmente devido ao seu papel na formação dos hormônios reguladores dos ossos e algumas enzimas envolvidas no metabolismo ósseo. | Chás, pães e cereais, castanhas, hortaliças verdes. |
| Potássio | Ingestão alta de potássio tem sido associada a massa óssea aumentada. Muito dos efeitos do potássio nos ossos podem ser indiretos e devido a proteção fornecida contra uma alta carga ácida que pode influenciar a reabsorção óssea para liberar cálcio. Certamente, a ingestão de sais de potássio tem sido mostrada na redução da reabsorção óssea e excreção urinária de cálcio. | Banana, brócolis, mandioquinha, couve de Bruxelas, castanhas e sementes, peixes e mariscos, carnes. |
| Ferro | Tem papel importante no metabolismo de vitamina D e síntese de colágeno. Indivíduos com distúrbios no metabolismo do ferro tem sido apontados a terem menor massa óssea e risco aumentado de sofrerem fraturas devido a osteoporose. Interessantemente, uma ingestão muito alta de ferro pode ser também ruim aos ossos, mais provavelmente devido ao estresse oxidativo aumentado e resposta inflamatória. | Fígado (não durante gravidez), carnes, feijões, castanhas, cereais integrais, frutas secas, hortaliças verdes folhosas. |
| Vitamina K | Baixa ingestão tem sido associada a osteopenia e maior risco de fraturas. Fisiologicamente, a vitamina K tem também sido relacionada com subcarboxilação da osteocalcina, enquanto a suplementação com a vitamina K pode reduzir o turnover ósseo e melhorar a força dos ossos. | Hortaliças verdes folhosas, óleos vegetais, grãos de cereais. |
| Proteína | Parte da matriz orgânica óssea como estrutura de colágeno. Papel na produção de hormônios e fatores de crescimento que modulam a síntese óssea. Proteínas podem ter um efeito indireto nos ossos pelo suporte da massa muscular e função muscular mas também via o aumento do fator de crescimento semelhante à insulina tipo 1 (IGF-1), que tem efeito anabólico nos ossos. | Carnes, laticínios (leite, iogurte, queijo), ovos, peixes, castanhas, feijões e pulses. |
| Cálcio | O principal mineral de formação óssea. Os ossos estocam 99% do cálcio corporal. Por outro lado, níveis baixos de cálcio na dieta podem contribuir com um efeito catabólico nos ossos através da ativação do hormônio da paratireoide PTH. | Laticínios (leite, queijo, iogurte), espinafre, couve, quiabo, soja, feijão branco. |
| Silício | A deficiência é associada com desenvolvimento esquelético pobre, provavelmente devido a sua importância no início da mineralização óssea, apesar de seu papel fisiológico ainda ser pouco compreendido. | Banana, cerveja, feijão verde, pão, arroz, cenoura, cereais. |
| Fósforo | O fósforo tem papel integral na formação óssea já que é constituinte essencial na mineralização dos ossos, e baixos níveis de fósforo contribuem para uma mineralização óssea prejudicada. Igualmente, existem problemas em dietas que são muito altas em fósforo, particularmente se combinadas com uma baixa ingestão dietética de cálcio, que pode levar a um aumento da PTH e efeito catabólico nos ossos. | Laticínio (leite, iogurte), carnes, aves, peixes, castanhas, feijões. |
| Vitamina D | Um importante mediador direto e/ou indireto dos ossos, é certamente importante para a absorção intestinal do cálcio e do fósforo, via estimulação da vitamina D(1,25(OH)2D), que é subsequentemente relacionada a secreção de PTH e respectiva atividade. | Peixes gordos (atum, salmão, sardinha), queijo, gema de ovos, alimentos fortificados. |
| Magnésio | Mais da metade do estoque de magnésio corporal fica nos ossos, e possui um papel importante na síntese da matriz orgânica óssea. A regulação controlada da homeostase de magnésio é sugerida como sendo importante a saúde óssea, devido ao fato da possibilidade de efeito negativo em ambos casos de deficiência ou excesso de magnésio. A deficiência de magnésio contribui diretamente para a pior saúde óssea (devido à importância tanto para os osteoblastos como osteoclastos), e indiretamente impactando a vitamina D e cálcio, influenciando a secreção de PTH e respectiva atividade. Por outro lado, níveis excessivos de magnésio também têm sido associados com defeitos na mineralização óssea. | Cereais integrais, espinafre, castanhas (amêndoas, castanha de caju, amendoim), quinua, abacate, laticínios. |
| Zinco | Tem papel importante na mineralização do tecido ósseo e na síntese da matriz orgânica óssea, de maneira que o status de zinco pode ser relacionado diretamente com o turnover ósseo. Pode também ser importante para a ação fisiológica da vitamina D no cálcio, além de potencialmente também influenciar indiretamente a secreção de PTH. | Carnes, mariscos, castanhas, sementes, leguminosas. |
| Vitamina C | A deficiência de vitamina C levando ao escorbuto tem sido amplamente divulgada em causar dor nos ossos. A vitamina C também é importante para a síntese de colágeno e é também um conhecido antioxidante, que pode explicar ambos os efeitos diretos e indiretos nos ossos. | Frutas (laranja, suco de laranja, morango, acerola, goiaba, caju, kiwi, limão), brócolis, couve de Bruxelas. |
| Vitamina A | Talvez um dos nutrientes mais controversos em relação a sua ligação com a saúde óssea. Existem sugestões de que a alta ingestão dietética da vitamina A está associada com maior risco de osteoporose e fratura do quadril. Por outro lado, ingestão de algum dos carotenoides, precursores da vitamina A, tem sido associada com maior massa óssea. Mais pesquisas são necessárias para determinar uma ingestão ideal de vitamina A para a saúde óssea. | Fígado e produtos do fígado (não durante a gravidez), laticínios (leite, queijo, iogurte), ovos, peixes gordurosos. |
| Vitaminas do complexo B | Uma associação entre a ingestão de vitamina B2, B6, folato e B12 e a redução do risco de osteoporose e fratura do quadril relacionada tem sido sugerida. Do mesmo modo, baixa ingestão de vitamina do complexo B tem sido mostrada em pacientes com fratura do quadril. Explicações sobre os mecanismos da ligação entre as vitaminas do complexo B e os ossos incluem o efeito positivo sobre a formação crosslink de colágeno e uma atividade aumentada de reabsorção óssea na deficiência de vitaminas do complexo B. | Laticínios (queijo, leite), frutas secas e frescas, carnes e hortaliças. |
Tabela: Alguns nutrientes chave que auxiliam a saúde óssea. Para mais informações nas quantidades recomendadas e fontes, o leitor pode se basear em – Europa: Autoridade em Segurança Alimentar Europeia, Austrália e Nova Zelândia: Conselho Nacional de Pesquisas Médicas e Saúde, Estados Unidos: Instituto de Medicina.
QUESTÕES ESPECÍFICAS AOS ATLETAS
Apesar de muitas das necessidades nutricionais que auxiliam a saúde óssea durante o crescimento e envelhecimento serem similares em atletas e na população em geral, existem alguns desafios nutricionais/dietéticos específicos no caso dos atletas. Esses incluem disponibilidade energética, baixa disponibilidade de carboidratos, ingestão de proteínas, ingestão de vitamina D, e perda de sódio e cálcio pelo suor. Nós consideramos atualmente que estes fatores são as questões mais pertinentes aos atletas, mas a lista não é de forma alguma completa e pesquisas contínuas poderão identificar futuras questões.
Disponibilidade Energética
Ambos o balanço energético e a disponibilidade energética têm sido utilizados para identificar a deficiência de energia em indivíduos fisicamente ativos. O balanço energético é simplesmente definido como o gasto total de energia menos a ingestão de energia pela dieta (Figura 1), com a disponibilidade energética sendo definida como a ingestão energética da dieta menos o gasto energético do exercício adequado a massa muscular. Desta forma, as duas diferem ligeiramente das seguintes maneiras: a) a estimação do gasto total de energia, necessário para determinar o balanço energético, pode introduzir mais fontes de equívocos comparado exclusivamente com a mensuração do gasto de energia do exercício; b) o balanço energético assume que sistemas corporais estão funcionando normalmente (mas o aumento no gasto de energia do exercício pode suprimir funções corporais). Portanto, em teoria, indivíduos podem estar em equilíbrio energético, mas experimentando baixa disponibilidade energética (Papageorgiou et al., 2017).
Enquanto a relação entre a baixa disponibilidade energética contínua ou a longo prazo e a saúde óssea é relativamente clara e bem descrita, particularmente em atletas do sexo feminino, como parte da Tríade da Mulher Atleta (Nattiv et al., 2007; De Souza et al., 2014), permanece incerto se a saúde óssea dos homens sofre ou não tanto como os efeitos da baixa disponibilidade energética em mulheres (Papageorgiou et al., 2017). Uma síndrome similar foi proposta em atletas do sexo masculino (Tenforde et al., 2016), onde se espelha as sugestões realizadas relacionadas a ocorrência da saúde óssea prejudicada como resultado da baixa disponibilidade energética, pela síndrome da Deficiência de Energia Relativa ao Esporte (RED-S) (Mountjoy et al., 2014; 2018).
Enquanto estar em um estado de muito baixa disponibilidade energética a longo prazo é claramente ruim para a saúde óssea, é menos claro se existe ou não um nível mínimo acima do qual a saúde óssea é protegida, mesmo que este nível caia abaixo do balanço energético de 45kcal/kg de massa magra corporal (MMC)-1/dia-1. Existem algumas sugestões do trabalho de Ihle e Loucks (2004) de que a formação óssea (ganho) é significativamente reduzida na disponibilidade energética de 30kcal/kg de MMC-1/dia-1, apesar de neste nível não parecer ter aumento na quantidade de reabsorção óssea (perda). Também não está claro se existe uma duração específica da baixa disponibilidade energética que influencia negativamente a saúde óssea e se importa se a baixa disponibilidade energética é continuamente ou intermitentemente aplicada. Claro que tudo isso pode ser bastante dependente ao nível do atleta. Pesquisas futuras são necessárias nesta área.

Figura 1
EI – ingestão energética
EE – gasto energético
Balanço energético positivo
Equilíbrio energético
Balanço energético negativo
Figura 1. A Relação entre a ingestão energética (EI) e o gasto energético (EE) contribuindo ao equilíbrio energético.
Baixa Disponibilidade de Carboidratos
Tem existido um aumento na popularidade de dietas com baixa quantidade de carboidratos, ou dietas “low carb” com alto teor de gorduras, adotadas pelas populações atléticas recentemente. Tal fato pode ser devido, pelo menos em parte, aos benefícios relatados para a composição corporal ou porque pode ajudar a conduzir ao fenótipo de resistência. Isto permanece uma questão controversa, dado que a ingestão de carboidratos normalmente fornece a maior contribuição a ingestão energética nas dietas dos atletas. Adicionalmente, existe uma preocupação que essa abordagem dietética poderia aumentar o risco de um estado de baixa disponibilidade energética, que afeta negativamente a saúde óssea e aumenta o risco de lesões. Existem alguns dados recentes que sugerem que a baixa disponibilidade de carboidratos pode até atuar negativamente nos ossos, independentemente da disponibilidade energética (Hammond et al., 2019), apesar da necessidade de futuras pesquisas para confirmarem estes resultados iniciais. Ainda que nenhum estudo tenha examinado os efeitos da dieta “low carb” na saúde óssea em atletas, Bjarnason et al. (2002) mostrou uma redução de ~50% na reabsorção óssea após um teste oral de tolerância a glicose. A provisão de carboidratos tem mostrado reduzir a resposta de reabsorção óssea ao exercício agudo em atletas completando oito dias de treino de resistência com sobrecarga (de Sousa et al., 2014). Além do mais, Sale et al. (2015) mostrou uma redução pós-exercício no turnover ósseo após alimentação com carboidrato durante uma corrida de 120 minutos em esteira em indivíduos ativos recreacionais. Em conjunto, estes estudos sugerem que a ingestão de carboidratos antes, durante ou após o exercício pode ser uma maneira útil de modificar a resposta óssea aos treinos e exercícios árduos em atletas, apesar da necessidade de futuras pesquisas para confirmar estes achados. Evidências de modelos animais sugerem que dietas baixas em carboidratos poderiam afetar negativamente a saúde óssea, particularmente quando seguidas juntamente de dietas com alta quantidade de gordura (Bielohuby et al., 2010). No estudo realizado por Bielohuby et al. (2010) a massa óssea e as propriedades mecânicas foram todas prejudicadas pelas dietas “low carb”/altas em gorduras, potencialmente mediadas pelas reduções do fator de crescimento semelhante à insulina tipo 1. Por outro lado em humanos, embora sendo pacientes com osteoartrite e não atletas, não existiu efeito no turnover ósseo quando os pacientes foram alimentados com menos de 20g de carboidratos por dia por um mês e depois com menos de 40g de carboidratos por dia pelos dois meses seguintes (Carter et al., 2006).
Ingestão de Proteínas
É frequentemente recomendado aos atletas que consumam quantidade maior de proteínas que a recomendada para a população em geral, para auxiliar a demanda adicional do treinamento atlético (Morton et al., 2018). Isto apresenta uma questão interessante em relação a saúde óssea desde que tem sido sugerido que ingestões maiores de proteínas podem ter efeito adverso na saúde óssea (para uma análise mais detalhada veja Dolan e Sale, 2018). Brevemente, a hipótese da cinza ácida propôs que proteínas animais são ácidas e, como tal, fornecem um desafio significativo na manutenção do balanço ácido-básico do corpo (Fenton et al., 2008). Para se proteger, o corpo aumenta a disponibilidade de minerais alcalinos, como o cálcio, em sua maioria estocados nos ossos (~99% no caso do cálcio). Isto necessitaria a quebra do tecido ósseo liberando cálcio para a circulação para reagir aos efeitos da acidez aumentada, com qualquer liberação excessiva de cálcio também sendo perdido pela urina. Com o tempo, este processo aumentaria a taxa de perda óssea e levaria a uma redução da DMO (Macdonald et al., 2005). Se a hipótese da cinza ácida estiver correta, um atleta consumindo uma dieta baseada em grande quantidade de proteína animal estaria em risco de afetar negativamente sua saúde óssea.
A hipótese da cinza ácida não fornece, no entanto, um relato completo da potencial influência de uma alta ingestão de proteínas nos ossos. Kerstetter et al. (2005) mostrou que ingestões maiores de proteínas resultam em uma quantidade aumentada de cálcio que é absorvido dos alimentos, e como tal, os níveis aumentados de cálcio na urina na alta ingestão de proteína animal pode na verdade surgir também de uma disponibilidade aumentada de cálcio. Além disso, uma carga ácida dietética aumentada pode facilmente ocorrer como resultado da ingestão reduzida de alimentos alcalinos (por exemplo, frutas e hortaliças) assim como do aumento na ingestão de alimentos ácidos tais como proteínas animais. O lado negativo é que a ingestão de proteínas pode ser benéfica para os ossos, dado que ela forma uma parte importante da estrutura óssea (Zimmerman et al., 2015), e a ingestão de proteínas aumenta a produção de um número de hormônios e fatores de crescimento envolvidos na formação óssea.
Acima de tudo, parece improvável que ingestões maiores de proteínas animais, nas quantidades recomendadas aos atletas, são prejudiciais à saúde óssea e, certamente, atletas podem necessitar consumir mais proteínas que a população em geral para auxiliar a taxa aumentada do turnover ósseo causado pelo treinamento atlético. Parece sensato garantir que a dieta do atleta contenha cálcio suficiente durante períodos de maior consumo proteico para reduzir o potencial efeito negativo nos ossos.
Ingestão de Vitamina D
Muitos estudos na última década identificaram grupos de atletas com níveis deficientes ou insuficientes de vitamina D circulante (veja Owens et al., 2015). Dado ao bem conhecido link entre baixos níveis de vitamina D (níveis plasmáticos de 25-hidroxivitamina D [25(OH)D] abaixo de 25nmol/L-1) e ossos, onde ela tem um papel importante na regulação de cálcio e fósforo no corpo, é bastante provável que os atletas que são deficientes de vitamina D terão maior risco de apresentarem baixa massa óssea (Holick, 2007) e mais lesões ósseas, como fraturas por estresse. Uma relação direta entre os níveis de vitamina D e resultados musculoesqueléticos é relativamente clara (Comitê Científico Consultivo em Nutrição, 2016) e, desta forma, evitar a deficiência e insuficiência de vitamina D é importante para que o atleta proteja a saúde óssea.
Perda de Cálcio pelo Suor
Atletas que são submetidos a um grande volume de exercícios prolongados podem estar em risco de perder cálcio pelo suor, o que pode em algumas circunstâncias atingir um nível que pode causar o declínio nas concentrações séricas de cálcio. Caso isso aconteça, ocorre um aumento resultante na secreção dos hormônios da paratireoide (PTH), que promove a quebra dos ossos para liberar cálcio na circulação para proteger os níveis séricos de cálcio (Figura 2). Barry et al. (2011) sugeriu que a suplementação de cálcio antes ou durante o exercício pode compensar a perda de cálcio pelo suor e proteger o nível sérico de cálcio, significando que não haveria aumento concomitante na secreção de PTH ou reabsorção óssea (Figura 2). Neste estudo, Barry et al. (2011) mostrou que a secreção de PTH foi menor durante período subsequente ao exercício quando 1000mg de cálcio foi ingerido antes do início do exercício.
Uma pesquisa do Instituto Australiano do Esporte (Haakonssen et al., 2015) também mostrou que o fornecimento de uma refeição rica em cálcio prévia ao exercício (~1350mg) foi suficiente para reduzir ambas a secreção de PTH e respostas a reabsorção óssea subsequente ao início de 90 minutos de pedalada, em ciclistas competidoras do sexo feminino. Dados recentes, no entanto, sugerem que perdas de cálcio pelo suor não são provavelmente a maior causa no aumento do hormônio da paratireoide e reabsorção óssea durante exercício de curta duração (Kohrt et al., 2019). É provável que a quantidade de cálcio perdida pelo suor seria apenas suficientemente significante para causar uma interferência na homeostase do cálcio e, portanto, no metabolismo ósseo em atividades de resistência ou ultra-resistência. Isto também poderia ser relevante para atletas sujeitos a ganho de peso, apesar deste fato ainda precisar ser melhor explorado.
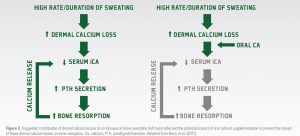
Figura 2
ALTA TAXA/DURAÇÃO DO SUOR
AUMENTA A PERDA DE CÁLCIO TÓPICA
DIMINUI O iCA SÉRICO
AUMENTA SECREÇÃO DE PTH
AUMENTA A REABORÇÃO ÓSSEA
(LIBERAÇÃO DE CÁLCIO)
ALTA TAXA/DURAÇÃO DO SUOR
AUMENTA A PERDA DE CÁLCIO TÓPICA
CÁLCIO ORAL
DIMINUI O iCA SÉRICO
AUMENTA SECREÇÃO DE PTH
AUMENTA A REABORÇÃO ÓSSEA
(LIBERAÇÃO DE CÁLCIO)
Figura 2. Contribuição sugerida da perda de cálcio pelo suor a uma reabsorção óssea aumentada (lado esquerdo) e o potencial impacto da suplementação oral de cálcio para prevenir o impacto desta perda de cálcio pelo suor na reabsorção óssea. CA, cálcio; PTH hormônio da paratireoide. Adaptado de Barry et al. (2011).
APLICAÇÕES PRÁTICAS
É difícil estabelecer recomendações práticas específicas para os efeitos da dieta na saúde óssea em atletas. Isso porque as evidências detalhadas, nas quais as recomendações se baseiam, não existem. Abaixo encontram-se os melhores conselhos baseados na interpretação da informação disponível atualmente:
- Atletas devem considerar uma avaliação nutricional bem conduzida de suas ingestões alimentares para identificar se estão consumindo ou não as quantidades necessárias dos nutrientes chave que auxiliam a saúde óssea, apesar desta avaliação ser repleta de dificuldades.
- Sempre que preferências alimentares e/ou prevenção a intolerâncias levarem a ingestão limitada de nutrientes importantes para a saúde óssea , atletas e médicos podem considerar a utilização de alimentos fortificados ou suplementação (considerando totalmente os aspectos de segurança quando isso ocorrer).
- A disponibilidade energética de ≥ 45kcal/kg de MMC-1/dia-1 é ideal no auxílio da saúde óssea em atletas, apesar deste número ser uma meta irreal para muitos. O conhecimento atual sugere tentar atingir a disponibilidade energética acima de 30kcal/kg de MMC-1/dia-1 para minimizar os efeitos negativos nos ossos.
- Dietas “low carb” (em casos agudos, crônicos ou periodicamente) podem influenciar negativamente a saúde óssea dos atletas, no entanto, não existem estudos disponíveis para fornecer base de evidência direta para que os médicos possam se basear.
- Atletas frequentemente consomem 2 a 3 vezes mais proteínas que a quantidade diária recomendada para a população em geral, o que hoje se pensa não ter efeito negativo sobre a saúde óssea (e possíveis efeitos benéficos), assumindo um consumo diário de cálcio adequado (>800 mg/dia-1; considerando também o ponto 6 abaixo).
- Se um atleta é deficiente de vitamina D ou tem insuficiência, é recomendado que o nível de vitamina D sérico acima de 50nmol/L-1 (20ng/mL-1) seja atingido (Instituto de Medicina, 2010), apesar de uma meta definitiva de vitamina D na prevenção da lesão óssea permanecer desconhecida.
- A perda de cálcio pelo suor pode ser uma consideração importante para alguns atletas de ultra-resistência, que provavelmente queiram considerar aumentar a ingestão de cálcio antes do exercício.
O QUE MAIS PRECISAMOS SABER?
-
- Ainda existe uma necessidade de definir de forma clara quais tipos de atletas estão ou não em risco a longo prazo para questões da saúde óssea, como osteopenia e osteoporose.
- Pesquisas futuras são necessárias para determinar as amplas implicações da disponibilidade energética reduzida, além dos ossos, como sugerido pela síndrome do RED-S já que atualmente elas não são pesquisadas a fundo.
- É preciso estabelecer claramente se existe uma tríade no atleta do sexo masculino e se as implicações para a saúde óssea da disponibilidade energética reduzida são encontradas no mesmo nível que em atletas do sexo feminino ou se homens são mais resistentes aos efeitos da baixa disponibilidade energética.
- Permanece a necessidade de determinar se existe ou não um limite além do qual a baixa disponibilidade energética (menor que 45kcal/kg de MMC-1/dia-1) não resulta em formação óssea reduzida.
- Pesquisas futuras são necessárias sobre a periodização da baixa disponibilidade energética em atletas de resistência, para que eles possam se beneficiar do efeito positivo da restrição de calorias no fenótipo de resistência, mas sem colocar a saúde óssea em risco.
- Mais trabalhos são necessários em atletas para determinar os efeitos da disponibilidade de nutrientes (particularmente carboidratos) separadamente da disponibilidade de energia na saúde óssea.
- Apesar da existência de dados que sugerem que o consumo e/ou a suplementação de cálcio pré-exercício podem reduzir a resposta de reabsorção óssea em exercícios de resistência, os efeitos crônicos desta estratégia na massa óssea e força não são ainda conhecidos
- As quantidades de cálcio perdidas durante os treinos em atletas de resistência e ultra-resistência ainda não são bem conhecidas. Também, a quantidade de cálcio perdida durante o suor mais passivo, particularmente em ambientes quentes, o que pode acontecer com atletas sujeito a ganho de peso também não é bem conhecido.
- Estudos a longo prazo são necessários para determinar se as respostas do metabolismo ósseo agudas ou de curto prazo à alimentação são positivas para a saúde óssea. Estes estudos também deveriam determinar se a alimentação deveria ser realizada periodicamente perto dos blocos de treino pesado ao invés de constantemente, para não reduzir a potencial adaptação do osso ao treino e exercício.
REFERÊNCIAS
Barry, D.W., K.C. Hansen, R.E. van Pelt, M. Witten, P. Wolfe, and W.M. Kohrt (2011). Acute calcium ingestion attenuates exercise-induced disruption of calcium homeostasis. Med. Sci. Sports Exerc. 43:617-623.
Bielohuby, M., M. Matsuura, N. Herbach, E. Kienzle, M. Slawik, A. Hoeflich, and M. Bidlingmaier (2010). Short-term exposure to low-carbohydrate, high-fat diets induces low bone mineral density and reduces bone formation in rats. J. Bone Miner. Res. 25:275-284.
Bjarnason, N.H., E.E. Henriksen, P. Alexandersen, S. Christgau, D.B. Henriksen, and C. Christiansen (2002). Mechanism of circadian variation in bone resorption. Bone 30:307–313.
Carter, J.D., F.B. Vasey, and J. Valeriano (2006). The effect of a low-carbohydrate diet on bone turnover. Osteoporos. Int. 17:1398-1403.
Clowes, J.A., R.A. Hannon, T.S. Yap, N.R. Hoyle, A. Blumsohn, and R. Eastell (2002). Effect of feeding on bone turnover markers and its impact on biological variability of measurements. Bone 30:886-890.
de Sousa, M.V., R.M. Pereira, R. Fukui, V.F. Caparbo, and M.E. da Silva (2014). Carbohydrate beverages attenuate bone resorption markers in elite runners. Metabolism 63:1536-1541.
De Souza, M.J., A. Nattiv, E. Joy, M. Misra, N.I. Williams, R.J. Mallinson, J.C. Gibbs, M. Olmsted, M. Goolsby, and G. Matheson (2014). Female athlete triad coalition consensus statement on treatment and return to play of the female athlete triad: 1st International Conference held in San Francisco, California, May 2012 and 2nd International Conference held in Indianapolis, Indiana, May 2013. Br. J. Sports Med. 48:289.
Dolan, E., and C. Sale (2018). Protein and bone health across the lifespan. Proc. Nutr. Soc. 78: 45-55.
Fenton, T.R., M. Eliasziw, A.W. Lyon, S.C. Tough, and D.A. Hanley (2008). Meta-analysis of the quantity of calcium excretion associated with the net acid excretion of the modern diet under the acid ash diet hypothesis. Am. J. Clin Nutr. 88:1159–1166.
Fredericson, M., K. Chew, J. Ngo, T. Cleek, J. Kiratli, and K. Cobb (2007). Regional bone mineral density in male athletes: a comparison of soccer players, runners and controls. Br. J. Sports Med. 41: 664-668.
Haakonssen, E.C., M.L. Ross, E.J. Knight, L.E. Cato, A. Nana, A.E. Wluka, F.M. Cicuttini, B.H. Wang, D.G. Jenkins, and L.M. Burke (2015). The effects of a calcium-rich pre-exercise meal on biomarkers of calcium homeostasis in competitive female cyclists: a randomised crossover trial. PLoS ONE 10(5):e0123302.
Hammond, K.M., C. Sale, W. Fraser, J. Tang, S.O. Shepherd, J.A. Strauss, G.L. Close, M. Cocks, J. Louis, J. Pugh, C. Stewart, A.P. Sharples, and J.P. Morton (2019). Post-exercise carbohydrate and energy availability induce independent effects on skeletal muscle cell signalling and bone turnover: implications for training adaptation. J Physiol. 597:4779-4796.
Hernlund, E., A. Svedbom, M. Ivergård, J. Compston, C. Cooper, J. Stenmark, E.V. McCloskey, B. Jönsson, and J.A. Kanis (2013). Osteoporosis in the European Union: medical management, epidemiology and economic burden. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch. Osteoporos. 8:136.
Holick, M.F. (2007). Vitamin D deficiency. N. Engl. J. Med. 357:266-281.
Ihle, R., and A.B. Loucks (2004). Dose-response relationships between energy availability and bone turnover in young exercising women. J. Bone Miner. Res. 19:1231-1240.
Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D: Institute of Medicine of the National Academies, 2010.
Kerstetter, J.E., K.O. O’Brien, D.M. Caseria, D.E. Wall, and K.L. Insogna (2005). The impact of dietary protein on calcium absorption and kinetic measures of bone turnover in women. J. Clin. Endocrinol. Metab. 90:26-31.
Kohrt, W.M., P. Wolfe, V.D. Sherk, S.J. Wherry, T. Wellington, E.L. Melanson, C.M. Swanson, C.M. Weaver, and R.S. Boxer (2019). Dermal calcium loss is not the primary determinant of parathyroid hormone secretion during exercise. Med. Sci. Sports Exerc. 51:2117-2124.
Larson-Meyer, D.E., K. Woolf, and L. Burke (2018). Assessment of nutrient status in athletes and the need for supplementation. Int. J. Sports Nutr. Exerc. Metab. 28:139-158.
Macdonald, H.M., S.A. New, W.D. Fraser, M.K. Campbell, and D.M. Reid (2005). Low dietary potassium intakes and high dietary estimates of net endogenous acid production are associated with low bone mineral density in premenopausal women and increased markers of bone resorption in postmenopausal women. Am. J. Clin. Nutr. 81:923–933.
McBryde, A.M. (1985). Stress fractures in runners. Clin. Sports Med. 4:737-752.
Mitchell, P.J., C. Cooper, B. Dawson-Hughes, C.M. Gordon, and R. Rizzoli (2015). Life-course approach to nutrition. Osteoporos. Int. 26:2723-2742.
Moran, D.S., Y. Heled, Y. Arbel, E. Israeli, A.S. Finestone, R.K. Evans, and R. Yanovich (2012). Dietary intake and stress fractures among elite male combat recruits. J Int Soc Sports Nutr. 9(1), 6.
Morton, R.W., K.T. Murphy, S.R. McKellar, B.J. Schoenfeld, M. Henselmans, E. Helms, A.A. Aragon, M.C. Devries, L. Banfield, J.W. Krieger, and S.M. Phillips (2018). A systematic review, meta-analysis and meta-regression of the effect of protein supplementation on resistance training-induced gains in muscle mass and strength in healthy adults. Br. J. Sports Med. 52:376–384.
Mountjoy, M., J. Sundgot-Borgen, L. Burke, S. Carter, N. Constantini, C. Lebrun, N. Meyer, R. Sherman, K. Steffen, R. Budgett, and A. Ljungqvist (2014). The IOC consensus statement: beyond the female athlete triad–relative energy deficiency in sport (RED-S). Br. J. Sports Med. 48:491-497.
Mountjoy, M., J.K. Sundgot-Borgen, L.M. Burke, K.E. Ackerman, C. Blauwet, N. Constantini, C. Lebrun, B. Lundy, A.K. Melin, N.L. Meyer, R.T. Sherman, A.S. Tenforde, M. Klungland Torstveit, and R. Budgett. (2018). IOC consensus statement on relative energy deficiency in sport (RED-S): 2018 update. Br. J. Sports Med. 52:687-697.
National Institute for Health and Clinical Excellence. Osteoporosis fragility fracture risk – Costing report. 2012.
Nattiv, A., A.B. Loucks, M.M. Manore, C.F. Sanborn, J. Sundgot-Borgen, and M.P. Warren (2007). American College of Sports Medicine position stand. The female athlete triad. Med. Sci. Sports Exerc. 39:1867-1882.
Owens, D.J., W.D. Fraser, and G.L. Close (2015). Vitamin D and the athlete: emerging insights. Eur. J. Sport Sci. 15:73-84.
Palacios, C. (2006). The role of nutrients in bone health, from A to Z. Crit. Rev. Food Sci. Nutr. 46: 621-628.
Papageorgiou, M., K.J. Elliott-Sale, A. Parsons, J.C.Y. Tang, J.P. Greeves, W.D. Fraser, and C. Sale (2017). Effects of reduced energy availability on bone metabolism in women and men. Bone 105:191-199.
Ranson, C.A., A.F. Burnett, and R.W. Kerslake (2010). Injuries to the lower back in elite fast bowlers: acute stress changes on MRI predict stress fracture. J. Bone Joint Surg. Br. 92:1664-1668.
Sale, C., I. Varley, T.W. Jones, R.M. James, J.C. Tang, W.D. Fraser, and J.P. Greeves (2015). Effect of carbohydrate feeding on the bone metabolic response to running. J. Appl. Physiol. 119:824-830.
Scientific Advisory Committee on Nutrition. Vitamin D and Health. 2016; https://www.gov.uk/government/groups/scientific-advisory-committee-on-nutrition.
Tenforde, A.S., M.T. Barrack, A. Nattiv, and M. Fredericson (2016). Parallels with the female athlete triad in male athletes. Sports Med. 46:171-182.
Walsh, J.S., and D.B. Henriksen (2010). Feeding and bone. Arch. Biochem. Biophys. 503:11-19.
Zimmermann, E.A., B. Busse, and R.O. Ritchie (2015). The fracture mechanics of human bone: influence of disease and treatment. Bonekey Rep. 4:743.






