SSE #205: REGULAÇÃO DO METABOLISMO DE GORDURA DURANTE O EXERCÍCIO
Publicado em
July 2020
Autor
Lawrence L. Spriet, PhD; Rebecca K. Randell, PhD
PONTOS-CHAVE:
- A gordura e o carboidrato (CHO) são as principais fontes de energia para o metabolismo aeróbico durante o exercício em um indivíduo que se encontra em um bom estado nutricional.
- A gordura é a fonte de energia predominante em atividades aeróbicas de baixa intensidade (VO2max <40%) e fornece ~50% da energia necessária durante exercícios de intensidade moderada (VO2max de ~40-66%). A contribuição da gordura é menor em atividades com intensidade mais elevada já que o CHO se torna a principal fonte de energia nestes casos.
- A oxidação da gordura também contribui como fonte de energia no período de recuperação após uma sessão única de exercício, nos períodos de descanso, e também nos momentos de menor intensidade que acontecem entre os tipos de exercício de alta intensidade comuns em esportes “stop and go”.
- A regulação do metabolismo de gordura na musculatura esquelética durante o exercício é complexa e envolve muitos locais de controle. A ativação da oxidação de gordura no momento do início do exercício é mais lenta que a de CHO e é destinada para períodos de exercício mais longos com intensidade baixa a moderada.
- A redução da oxidação de gordura no exercício aeróbico intenso ocorre em muitos locais de controle dentro e fora da musculatura esquelética.
INTRODUÇÃO
A gordura e o carboidrato (CHO) são as principais fontes para a geração de energia durante exercícios aeróbicos em indivíduos que se encontram em um bom estado nutricional. A contribuição relativa destas vias metabólicas é determinada principalmente pela intensidade e duração do exercício, mas também é afetada pelo tipo e nível de treinamento, pela dieta que antecede a atividade física, sexo do indivíduo e condições ambientais. Na esfera dos exercícios aeróbicos com volume de oxigênio máximo (VO2max) de até ~100%, o carboidrato é a fonte de energia predominante, já que o metabolismo oxidativo baseado no CHO pode ser ativado rapidamente, pode fornecer toda a energia necessária em atividades de alta intensidade (VO2max >85-90%) e é uma fonte de energia mais eficiente (kcal/L de O2 utilizado) quando em comparação com a gordura. No entanto, enquanto o metabolismo oxidativo da gordura é ativado mais lentamente e fornece menos energia, à medida que a intensidade do exercício aumenta além do VO2max de 65-75%, ele tem uma capacidade muito maior que a oxidação de CHO. A gordura é destinada para ser a fonte de energia auxiliar durante exercícios aeróbicos, é a fonte de energia predominante em atividades com baixa intensidade (VO2max <40%) e fornece grande quantidade de energia durante exercícios de intensidade moderada (VO2max de ~40-65%). Se o exercício com VO2max de ~50-60% é prolongado para além de ~1-2horas, a gordura se torna novamente a fonte de energia predominante. Adicionalmente, a oxidação da gordura contribui com energia durante o período de recuperação após o exercício. O objetivo deste artigo do Sport Science Exchange é revisar de maneira resumida as informações mais recentes sobre a regulação da utilização de gordura durante o exercício. Este tópico foi examinado mais detalhadamente por muitos autores no passado (Glatz et al., 2010; Kiens, 2006; Sahlin, 2009; Spriet, 2012, 2014). Um segundo artigo do Sports Science Exchange sobre o metabolismo da gordura examina as estratégias nutricionais e de treinamentos que podem afetar as taxas de oxidação de gordura (Randell & Spriet, 2020).
A UTILIZAÇÃO DE GORDURA DURANTE O EXERCÍCIO
Durante o exercício que é de natureza aeróbica (com necessidade energética de até 100% do VO2max), a oxidação de CHO e de gordura fornece a energia necessária para a contração da musculatura esquelética. Outras potenciais fontes como os aminoácidos também podem contribuir com energia, mas esta contribuição é normalmente menor em indivíduos que se encontram em um bom estado nutricional. Os principais substratos no interior dos músculos (endógenos) para a produção aeróbica de energia são o glicogênio e os triglicerídeos intramusculares (TGIM) e no exterior da célula (exógenos) são a glicose sanguínea (derivada da glicogenólise e gliconeogênese no fígado, e do intestino quando o CHO é ingerido) e os ácidos graxos livre (AGLs) derivados dos estoque de triglicérides (TG) no tecido adiposo. A dependência destas quatro fontes de energia foi medida em ciclistas jovens com boa aptidão física do sexo masculino em diversas intensidades de exercício (Figura 1) utilizando a calorimetria indireta, técnicas de isótopos estáveis e biópsias da musculatura esquelética (Romijn et al., 1993). Foram realizadas medições durante os 30 minutos finais em uma atividade de ciclismo com duração de 2 horas e com o VO2max de 25 e 65%, e nos 10 minutos finais de uma atividade de ciclismo com duração de 30 minutos e com o VO2max de 85%. Um segundo estudo com resultados muito similares foi publicado por van Loon et al. em 2001.
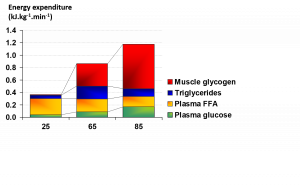
Tradução da Figura:
Gasto de energia (KJ/kg/min)
Glicogênio muscular
Triglicerídeos
Ácidos graxos livres do plasma (AGLs)
Glicose plasmática
Figura 1. A utilização de energia durante exercício com VO2max de 25, 65, e 85% (reproduzido de Romijn et al., 1993).
Estes dados forneceram diversos insights importantes relacionados a utilização de energia de acordo com o aumento da intensidade do exercício. Em um VO2max de 25%, a glicose e os AGLs foram transportados para a musculatura em uma velocidade que forneceu a energia necessária, sendo os AGLs a fonte de energia predominante nesta intensidade baixa (Figura 1). Quando a intensidade do exercício sofreu um aumento para um VO2max de 65% (intensidade moderada), a contribuição dos AGLs exógenos foi mantida, a contribuição da glicose exógena aumentou, e uma quantidade significativa de glicogênio muscular e TGIM também foi utilizada (Romijn et al., 1993). A contribuição da gordura atingiu o seu pico máximo em uma intensidade moderada e a contribuição total da gordura e do CHO foi de aproximadamente 50/50 (Figura 1). Pesquisas adicionais têm demonstrado que um exercício com intensidade de ~60-65% obtém oxidação máxima de gordura (Achten et al., 2022; Randell et al., 2017). Quando houve uma transição para 85% do VO2max (alta intensidade), a contribuição dos AGLs e TGIM foi reduzida, a dependência da glicose proveniente do sangue aumentou, e a utilização do glicogênio muscular se tornou a fonte de energia predominante. Resumindo, a oxidação de CHO, principalmente a partir do glicogênio muscular, foi predominante nos exercícios de alta intensidade e a oxidação de gordura foi mais importante nas intensidades baixas a moderadas.
Em experimentos similares com mulheres jovens ativas com boa aptidão física (Romijn et al., 2000), os dados sobre a utilização de energia com VO2max de 25, 65 e 85% foram basicamente idênticos àqueles encontrados nos indivíduos do sexo masculino (Romijn et al., 1993). Em indivíduos com menor aptidão física ou sem experiência atlética, a dependência do CHO é maior em atividades com intensidades moderadas a altas, e os exercícios com intensidade de ~60% ou mais do VO2max não podem ser sustentados por tanto tempo quanto em indivíduos mais capacitados fisicamente, mesmo que a intensidade absoluta seja muito menor (Coggan et al., 1995a, b; Howlett et al., 1998).
Watt et al. (2002) submeteu ciclistas com boa aptidão física à uma atividade de ciclismo com duração de 4 horas com VO2max de 55% e examinou a utilização de energia através da calorimetria indireta e medições da utilização de TGIM e do glicogênio da musculatura esquelética em amostras de biópsias (Figura 2). A oxidação do CHO foi predominante nas primeiras duas horas de atividade representando ~63% da provisão de energia, com o glicogênio fornecendo 45% e a glicose sanguínea 55% do total de CHO utilizado. A gordura representou 37% da utilização de energia nas duas primeiras horas, com a oxidação plasmática de AGLs contribuindo com 90% e a utilização de TGIM com apenas 10% (Figura 2). A glicose plasmática forneceu um pouco mais de energia (proveniente do sangue) do que os AGLs do plasma nas duas primeiras horas de exercício. No entanto, a oxidação de gordura aumentou ao longo do tempo e se tornou a fonte de energia predominante em ~2 horas de atividade à medida que a oxidação de carboidratos diminuiu de maneira constante. Nas 2-4 horas finais do exercício, a oxidação de gordura representou 58% da fonte de energia com praticamente todos os substratos sendo fornecidos pelos AGLs plasmáticos. Houve um aumento constante dos AGLs do plasma de ~0,2mmol/L em repouso para ~0,9 em 2 horas e 1,66 ± 0,32mmol/L em 4 horas (Watt et al., 2002). Enquanto a oxidação de CHO diminuiu nas 2 horas finais, ela forneceu 42% da energia e a maior parte foi derivada da captação da glicose sanguínea. A glicose sanguínea foi mantida razoavelmente estável pelo período de 4 horas de exercício e foi 4,9 ± 0,3mmol/L em repouso, 5,1± 0,3mmol/L em 1 hora e diminuiu para 4,0 ± 0,3mmol/L em 4 horas de atividade. Os níveis de lactato sanguíneo foram muito baixos por todo o ciclo de exercício, mas o glicerol plasmático aumentou de maneira constante de 119 ± 18umol/L em repouso para 701 ± 58umol/L em 4 horas (da quebra dos adipócitos e TGIM), fornecendo substrato para a gliconeogênese no fígado.
Nas 2 horas finais de exercício com VO2max de ~57% a fonte de energia proveniente do sangue representou 92% da energia oxidativa com os AGLs contribuindo com 60% e a glicose sanguínea com 40%. Estes dados demonstraram claramente uma redução da utilização de energia intramuscular na primeira metade de exercício prolongado e uma maior dependência dos AGLs e da glicose do sangue na segunda metade do total de 4 horas de atividade, com os AGLs plasmáticos servindo como fonte de energia predominante.
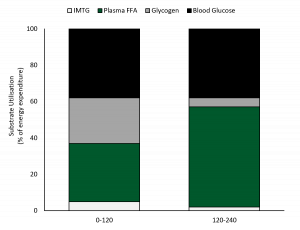
Figura 2. A utilização de energia durante 4 horas de exercício com VO2max de ~57% (reproduzido de Watt et al., 2002). FFA = ácidos graxos livres; IMTG = triglicerídeos intramusculares.
Tradução da figura:
Utilização de substrato (% do gasto de energia)
TGIM
AGLs do plasma
Glicogênio
Glicose sanguínea
REGULAÇÃO DO METALISMO DE GORDURA DURANTE O EXERCÍCIO
A musculatura esquelética tem vias metabólicas muito bem desenvolvidas para lidar com a demanda repentina e contínua de energia ou adenosina trifosfato (ATP) durante o exercício. Grande parte da ressíntese de ATP a partir dos subprodutos da degradação do ATP, adenosina difosfato (ADP) e fosfato inorgânico (Pi), ocorre através da fosforilação oxidativa (“aeróbica”) na cadeia transportadora de elétrons (CTE) da mitocôndria. A CTE necessita de equivalentes redutores do metabolismo de CHO e da gordura, ADP, Pi, e oxigênio para regenerar ATP (Figura 3).
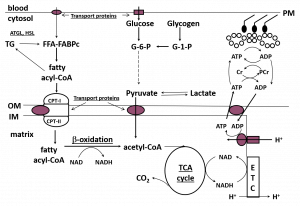
Figura 3. Esquema do metabolismo de gordura na musculatura esquelética. FFA, ácidos graxos livres; ALB, albumina; BF, fluxo sanguíneo; ATGL, lipase dos triglicerídeos dos adipócitos; HSL, lipase hormônio sensível; FABPc, proteína para ligação de ácidos graxos no citoplasma; CPT I and II, carnitina palmitol transferase I and II; OM, membrana exterior; IM, membrana interior; TCA, ciclo do ácido tricarboxílico; ETC, cadeia transportadora de elétrons; G-6-P, glicose 6-fosfato; G-1-P, glicose 1-fosfato; Cr, creatina; PCr, fosfocreatina. “Sublinhado” denota locais de regulação de gordura.
Tradução da figura:
Sangue// citosol
Proteínas transportadoras
Glicose//Glicogênio
Acil-CoA graxo
Piruvato//Lactato
Matriz
Beta-oxidação
Acetil-CoA
Ciclo do TCA
Pesquisas nos últimos 15-20 anos têm demonstrado que a regulação do metabolismo de gordura é complexa e envolve muitos locais de controle, incluindo o transporte de gordura para dentro da célula muscular, a ligação com uma proteína chaperona e o movimento da gordura no citoplasma, a regulação da síntese e quebra de TGIM no citoplasma, e o transporte de gordura para dentro da mitocôndria (Figura 3). A gordura então entra na via de beta-oxidação que produz equivalentes redutores (NADH, FADH2) e acetil-CoA que são utilizados na CTE para gerar energia e o ciclo do ácido tricarboxílico (Krebs) (TCA) para produzir mais equivalentes, respectivamente. A via de beta-oxidação não parece ser regulada externamente e pode simplesmente ser ativada pela oferta de substratos, mas há uma regulação adicional que ocorre em três pontos no ciclo do TCA (Kiens, 2006; Sahlin, 2009; Spriet, 2012, 2014). É consenso que, na presença de equivalentes redutores e oxigênio em abundância, o aumento de ADP no início do exercício aumenta o fluxo da CTE para a ressíntese de ATP (Holloway, 2017; Sahlin, 2009).
A descoberta da proteína que assiste o transporte da gordura pelo plasma e membranas mitocondriais, a habilidade desta proteína em se translocar através das membranas durante o exercício e os novos papéis da lipase dos triglicerídeos dos adipócitos (ATGL) e lipase hormônio sensível (HSL) na regulação da lipólise na musculatura esquelética são exemplos de descobertas recentes na regulação do metabolismo de gordura.
Transporte da Gordura através das Membranas
Está claro atualmente que a maioria dos AGLs que se movem para dentro das células musculares durante o exercício não se deve à uma difusão simples, mas acontece sendo facilitado pela membrana muscular e túbulos-T através de um sistema de transporte mediado por proteínas (Bonen et al., 2000; Holloway et al., 2006; Stefanyk et al., 2012). Esta evidência surgiu de outros trabalhos demonstrando que o movimento dos AGLs pela membrana muscular era um processo saturável envolvendo proteínas (Turcotte et al., 1991, 2000). Estas proteínas transportadoras incluem a proteína para ligação com os ácidos graxos na membrana plasmática (FABPpm), proteínas translocase de ácidos graxos (FAT/CD36) e proteínas transportadoras de ácidos graxos (FATP). Uma vez no citoplasma, os AGLs são conectados à uma proteína chaperona (proteína transportadora de ácido graxo no citoplasma) para serem transportados para um estoque na forma de TGIM ou fornecidos para a mitocôndria para oxidação (Figura 3).
Os AGLs (do exterior da célula e/ou liberados a partir dos TGIM) devem ser transportados através das membranas mitocondriais com o auxílio do sistema carnitina palmitol transferase I (CPT I) e proteínas transportadoras de gordura (principalmente a FAT/CD36) (Holloway et al., 2006; Smith et al., 2012b). Durante o exercício agudo, as proteínas transportadoras de gordura também são conduzidas através das membranas musculares (principalmente a FABPpm) e membranas mitocondriais (principalmente a FAT/CD36) para auxiliar a trazer gorduras para dentro da mitocôndria, mas isto ocorre em um período de tempo mais lento (~15-30 minutos) do que o movimento (s por minutos) do transportador de glicose (GLUT4) (Halloway et al., 2006; Bradley et al., 2012). Foi proposto que a FAT/CD36 está localizada na membrana mitocondrial mais externa e que de alguma maneira inexplicável, facilita a entrega de ácidos graxos de cadeia longa para a enzima sintase acetil-CoA para ser ativada e assim poder interagir com o complexo CPT e ser transferida para dentro da mitocôndria (Smith et al., 2012a, b).
Na musculatura esquelética humana, exercícios aumentaram o conteúdo de FABPpm nas membranas musculares e aumentaram o conteúdo de FAT/CD36 nas membranas mitocondriais em maior grau que o aumento no volume mitocondrial (Bradley et al., 2012; Talanian et al., 2010). Estas adaptações são coerentes com uma capacidade maior para oxidar a gordura após os exercícios dos treinamentos (Holloway & Spriet, 2009; Holloszy & Coyle, 1984; Perry et al., 2008).
Quebra de Triglicerídeos Intramusculares
A quebra de TGIM na musculatura também pode fornecer AGLs para a oxidação durante exercícios de intensidade baixa a moderada, sprints e exercícios de resistência (Romijn et al., 1993; Shepherd et al., 2013, 2014; Stellingwerff et al., 2007). Os exercícios dos treinamentos também aumentam o conteúdo de TGIM e a dependência dos TGIM durante o exercício (Goodpaster et al., 2001; Shepherd et al., 2013, 2014). As enzimas-chave envolvidas em regular a lipólise na musculatura esquelética são as ATGL, HSL e a monoacilglicerol lipase (MGL) que posteriormente removem os ácidos graxos (AGs) estocados em gotículas de gordura dos TGIM (Figura 3). As ATGL e HSL são extremamente controladas, enquanto a MGL não (Alsted et al., 2009; Prats et al., 2006). Outros fatores também têm um papel na quebra de TGIM, incluindo o tamanho da gotícula de gordura, a localização da gotícula e o fato de que as gotículas de gordura são envoltas por uma camada de proteínas (perilipinas) (Jevons et al., 2020; MacPherson & Peters 2015; Prats et al., 2006).
Metabolismo Mitocondrial da Gordura
Uma vez fora da mitocôndria, os AGs entram na via de beta-oxidação com a formação de acetil-CoA e equivalentes redutores (NADH, FADH2). Até o momento, não houve evidência concreta de que a regulação do metabolismo ocorra na via de beta-oxidação – ela simplesmente responde à provisão de substratos (Sahlin, 2009). Os equivalentes redutores gerados na via de beta-oxidação entram na CTE e junto com outros substratos, oxigênio, ADP e Pi livres, resultam na geração de ATP. A acetil-CoA produzida na via de beta-oxidação entra no ciclo do TCA (Krebs) e este ciclo se especializa em produzir mais equivalentes redutores e recebe a acetil-CoA tanto de CHOs quanto de gorduras (e em menor extensão de outras fontes). Durante o exercício aeróbico, as enzimas isocitrato, a alfa-cetoglutarato desidrogenase e uma terceira enzima, citrato sintase, são ativadas aumentando o fluxo através do ciclo do TCA (Sahlin, 2009). A combinação de equivalentes redutores produzidos nas vias de beta-oxidação e ciclo do TCA e os AGs de natureza de cadeia longa como o palmitato e o oleato resultam na produção de grande quantidade de ATP na CTE (Figura 3).
Regulação Geral da Gordura Utilizada como Fonte de Energia
O aumento da utilização de gordura durante o exercício é regulado por muitos dos mesmos sinais assim como o metabolismo de CHO. O aumento no Ca2+ no início do exercício ativa enzimas essenciais e processos envolvidos na regulação da degradação de TGIM (assim como a epinefrina), o movimento e a acoplagem das proteínas transportadoras de gordura nas membranas musculares e enzimas do ciclo do TCA na mitocôndria (Hargreaves & Spriet, 2017; Sahlin, 2009). Fatores locais relacionados com o nível de energia da célula incluindo aumentos no ADP livre e adenosina monofosfato (AMP), e a ativação da AMP quinase (AMPK) também contribuem com a regulação em diversos locais (Fentz et al., 2015; Jain et al., 2009, 2015), enquanto fatores incluindo o malonil-CoA, pH e a carnitina estão envolvidos na regulação do transporte de gordura através das membranas mitocondriais (Petrick & Holloway, 2019; Smith et al., 2012a).
Exercícios dos Treinamentos
Considerando que as vias de beta-oxidação e TCA existem na mitocôndria, o volume mitocondrial da célula muscular determina a capacidade geral de oxidar a gordura durante o exercício. O clássico trabalho de Holloszy e colegas demonstrou que treinos com exercícios aeróbicos e intermitentes de alta intensidade aumentaram o volume mitocondrial na musculatura esquelética em ratos e humanos (Holloszy, 1967; Holloszy et al., 1970; Mole et al., 1971). Enquanto suprimentos adequados de oxigênio, ADP, Pi e equivalentes redutores a partir da gordura são necessários para a produção de ATP mitocondrial, o volume mitocondrial ou o mecanismo disponível para gerar ATP também é importante. Portanto, um maior volume mitocondrial após os treinamentos fornece os meios para a maior capacidade de produzir NADH a partir da gordura, e então mais ATP na CTE (Holloway & Spriet, 2009; Perry et al., 2008). O treinamento também resulta na evidência clássica de que a dependência da gordura como fonte de energia aumenta em uma certa intensidade submáxima absoluta após o treinamento (Holloszy & Coyle, 1984; Perry et al., 2008). Outras consequências importantes dos exercícios dos treinamentos incluem melhor habilidade de fornecer e absorver AGLs para dentro da musculatura (Turcotte et al., 1992), maior reserva de TGIM (Goodpaster et al., 2001), supra-regulação da atividade da ATGL, e aumento do conteúdo de proteínas transportadoras de gordura nas membranas musculares e mitocondriais (Bradley et al., 2012; Talanian et al., 2010).
A Dependência Menor de Gordura em Exercícios com Maiores Intensidades
Durante eventos intensos de resistência, os atletas estão frequentemente competindo em um VO2max de ~85-95% e a utilização de substratos como fonte de energia é reduzida para as gorduras e maior para os CHOs (Figura 1). De um ponto de vista de performance esta mudança da fonte de energia faz sentido já que o rendimento da energia da oxidação de carboidratos é ~7% mais eficiente do que da oxidação de gorduras. Recentemente, pesquisas identificaram diversos pontos de controle onde o metabolismo de gordura é reduzido em exercícios com alta intensidade aeróbica, incluindo menor liberação de AGLs do tecido adiposo, menor transporte para a musculatura e portanto menor transporte de AGLs para dentro dos músculos, ativação reduzida da HSL e possivelmente da ATGL e menor quebra de TGIM, inibição da atividade da CPT I devido à pequenas reduções no pH muscular, menor sensibilidade da CPT I à carnitina, e possivelmente baixos níveis de carnitina citoplasmática, reduzindo o transporte através das membranas mitocondriais (Petrick & Holloway 2019; Smith et al., 2012a; Spriet, 2014).
O METABOLISMO DA GORDURA DURANTE A RECUPERAÇÃO DO EXERCÍCIO
Relativamente, a atenção de apenas um pequeno número de pesquisas tem sido direcionada à importância da gordura coma fonte de energia na musculatura esquelética durante períodos de recuperação em repouso após um exercício prolongado, durante o descanso ou em momentos de baixa intensidade entre exercícios de alta intensidade. Após o exercício prolongado, a Razão de Troca Respiratória (RER) pode não estimar precisamente a utilização da gordura pela musculatura esquelética já que a taxa metabólica dos músculos se encontra mais baixa e não direciona os materiais de trocas gasosas como acontece no exercício. Adicionalmente, outros processos metabólicos envolvendo a utilização do dióxido de carbono podem afetar a RER medida. Durante o exercício intermitente, onde momentos de descanso são frequentemente curtos, a obtenção de um estado estável para a medição das trocas gasosas e a utilização da RER para estimar a utilização de gordura também é dificultada.
Apesar de todas estas questões, estudos têm indicado que a oxidação de gordura se encontra elevada após os exercícios quando em comparação com uma situação controle de descanso (repouso) (Henderson et al., 2007; Malatesta et al., 2009). Para driblar as questões com a RER durante a recuperação Henderson et al. (2007) mediu a oxidação dos AGs em todo o corpo com C-palmitato por 3 horas após exercício de 90 minutos com VO2max de 45% e após exercício de 60 minutos com VO2max de 65% e uma condição controle em repouso nos mesmos intervalos de tempo em homens e mulheres moderadamente ativos. A oxidação plasmática dos AGs foi maior do que a de repouso por todas as 3 horas do período de recuperação em ambos os sexos. Não houve diferença entre as duas durações de exercício, mas a oxidação total de AGs foi maior nos homens do que nas mulheres. Diversos outros estudos têm relatado a oxidação elevada de gordura por diversas horas após o término do exercício com depleção de glicose em homens e mulheres com boa aptidão física, baseando-se em medidas da RER e apesar do consumo de alimentos ricos em CHO após o exercício. Na maioria dos estudos, as reservas de TGIM não diminuíram e frequentemente aumentaram nos períodos de recuperação de 18-30 horas (Decombaz et al., 2001; Kimber et al., 2003; Larson-Meyer et al., 2002), apesar de um estudo ter relatado uma redução nos TGIM após 18 horas da recuperação em indivíduos do sexo masculino em boa forma física (Kiens & Richter, 1998). Estes dados sugerem que os AGs plasmáticos e possivelmente as lipoproteínas de muito baixa densidade provavelmente são as fontes de energia principais na recuperação imediata após os exercícios aeróbicos.
Maletesta et al. (2009) examinou a oxidação lipídica durante 3 horas na recuperação de um exercício intermitente submáximo com alta intensidade (1 minuto com VO2max de 80%, com 1 minuto de recuperação ativa em 40% do VO2max), 60 minutos de exercício em 45% do VO2max, e em um teste controle em repouso com o mesmo intervalo de tempo em homens muito ativos. O aumento na oxidação total de substratos e na oxidação de gordura após dois testes de exercícios isoenergéticos foi o mesmo do período de recuperação e maior do que no teste controle. Isto ocorreu apesar da menor oxidação de gordura durante o teste de exercício intermitente em comparação com o teste de intensidade constante, sugerindo que o gasto total de energia ditou a taxa de oxidação de gordura durante as 3 horas do período de recuperação. Claramente existe a necessidade de mais pesquisas examinando a utilização das fontes de energia durante períodos de recuperação após os exercícios e melhores métodos para estimar a utilização de gordura e de CHO em curtos períodos de recuperação ou momentos de baixa intensidade entre exercícios de alta intensidade.
CONCLUSÕES
A gordura é uma fonte de energia importante nos exercícios com intensidade baixa a moderada, especialmente se o exercício é prolongado. A regulação do metabolismo de gordura na musculatura esquelética durante o exercício é complexa e envolve muitos locais de controle. A ativação da oxidação de gordura no momento do início do exercício é mais lenta do que a de CHO e é destinada para períodos mais longos de exercícios com intensidade baixa a moderada, já que sua capacidade é muito maior do que a de CHO. Diversos locais de controle para a redução do metabolismo de gordura foram identificados para explicar a diminuição na oxidação de gordura durante exercícios aeróbicos com alta intensidade. Mais pesquisas são necessárias para determinar a importância da gordura como fonte de energia durante o período de recuperação após uma sessão única de exercício e nos momentos de baixa intensidade que acontecem entre os tipos de exercício de alta intensidade comuns em esportes “stop and go”.
Rebecca Randell é colaboradora do Gatorade Sports Science institute, os pontos de vistas expressos neste artigo são dos autores e não refletem necessariamente a posição ou política da PepsiCo, Inc.
REFERÊNCIAS
Achten, J., M. Gleeson, and A.E. Jeukendrup (2002). Determination of the exercise intensity that elicits maximal fat oxidation. Med. Sci. Sports Exerc. 34: 92-97.
Alsted, T.J., L. Nybo, M. Schweiger, C. Fledelius, P. Jacobsen, R. Zimmermann, R. Zechner, and B. Kiens (2009). Adipose triglyceride lipase in human skeletal muscle is upregulated by exercise training. Am. J. Physiol. 296:E445-453.
Bonen, A., J.J. Luiken, Y. Arumugam, J.F. Glatz, and N.N. Tandon (2000). Acute regulation of fatty acid uptake involves the cellular redistribution of fatty acid translocase. J. Biol. Chem. 275:14501-14508.
Bradley, N.S., L.A. Snook, S.S. Jain, G.J.F. Heigenhauser, A. Bonen, and L. . Spriet (2012). Acute endurance exercise increases plasma membrane fatty acid transport proteins in rat and human skeletal muscle. Am. J. Physiol. 302:E183-189.
Coggan, A.R., C.A. Raguso, B.D. Williams, L.S. Sidossis, and A. Gastaldelli (1995a). Glucose kinetics during high-intensity exercise in endurance-trained and untrained humans. J. Appl. Physiol. 78:1203-1207.
Coggan, A.R., S.C. Swanson, L.A. Mendenhall, D.L. Habash, and C.L. Kien (1995b). Effect of endurance training on hepatic glycogenolysis and gluconeogenesis during prolonged exercise in men. Am. J. Physiol. 268:375-383.
Decombaz, J., B. Schmitt, M. Ith, B. Decarli, P. Diem, R. Kreis, H. Hoppeler, and C. Boesch (2001). Postexercise fat intake repletes intramyocellular lipids but no faster in trained than in sedentary subjects. Am. J. Physiol. 281:R760-R769.
Fentz. J., R. Kjobsted, J.B. Birk, J. Jeppesen, K. Thorsen, P. Schjerling, B. Kiens, N. Jessen, B. Viollet, and J.F. Wojtaszewski (2015). AMPKα is critical for enhancing skeletal muscle fatty acid utilization during in vivo exercise in mice. FASEB J. 29:1725-1738.
Goodpaster, B.H., J. He, S. Watkins, and D.E. Kelley (2001). Skeletal muscle lipid content and insulin resistance: evidence for a paradox in endurance-trained athletes. J. Clin. Endocrinol. Metab. 86:755–5761.
Glatz, J.F., J.J. Luiken, and A. Bonen (2010). membrane fatty acid transporters as regulators of lipid metabolism; Implications for metabolic disease. Physiol. Rev. 90:367-417.
Hargreaves, M., and L.L. Spriet (2017). Exercise metabolism: Fuels for the fire. In: The Biology of Exercise. Zierath, J.R., M.J. Joyner, and J.A. Hawley (eds). Cold Spring Harbor Laboratory Press. Cold Spring Harbor, USA. pp. 57-72.
Henderson, G.C., J.A. Fattor, M.A. Horning, N. Faghihnia, M.L. Johnson, T.L. Mau, M. Luke-Zeitoun, and G.A. Brooks (2007). Lipolysis and fatty acid metabolism in men and women during the postexercise recovery period. J. Physiol. 584:963-981.
Holloway, G.P. (2017). Nutrition and training influences on the regulation of mitochondrial adenosine diphosphate sensitivity and bioenergetics. Sports Med. 47:S13-S21.
Holloway, G.P., and L.L. Spriet (2009). Skeletal muscle metabolic adaptations to training. In: The IOC Textbook of Science in Sport. R.J. Maughan (Ed): O. Wiley-Blackwell, UK. pp. 70-83.
Holloway, G.P., V. Bezaire, G.J.F. Heigenhauser, N.N. Tandon, J.F. Glatz, J.J. Luiken, A. Bonen, and L. L. Spriet (2006). Mitochondrial long chain fatty acid oxidation, fatty acid translocase/CD36 content and carnitine palmitoyltransferase I activity in human skeletal muscle during aerobic exercise. J Physiol 571: 201-210.
Holloszy, J.O. (1967). Biochemical adaptations in muscle. Effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. J. Biol. Chem. 242:2278–2282.
Holloszy, J.O., and E.F. Coyle (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl. Physiol. 56:831–838.
Holloszy, J.O., L.B. Oscai, I.J. Don, and P.A. Mole (1970) Mitochondrial citric acid cycle and related enzymes: adaptive response to exercise. Biochem. Biophys. Res. Commun. 40:1368–1373.
Howlett, R.A., M.L. Parolin, D.J. Dyck, E. Hultman, N.L. Jones, G.J.F. Heigenhauser, and L.L. Spriet (1998). Regulation of skeletal muscle glycogen phosphorylase and pyruvate dehydrogenase at varying power outputs. Am. J. Physiol. 275:R418-R425.
Jain, S.S., A. Chabowski, L.A. Snook, R.W. Schwenk, J.F. Glatz, J.J. Luiken, and A. Bonen (2009). Additive effects of insulin and muscle contraction on fatty acid transport and fatty acid transporters, FAT/CD36, FABPpm, FATP1, 4 and 6. FEBS Lett. 583:2294-2300.
Jain, S.S., J.J. Luiken, L.A. Snook, X.X. Han, G.P. Holloway, J.F. Glatz, and A. Bonen (2015). Fatty acid transport and transporters in muscle are critically regulated by Akt2. FEBS Lett. 589:2769-2775.
Jevons, E.F.P., K.D. Gejl, J.A. Strauss, N. Ortenblad, and S.O. Shepherd (2020). Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. Am. J. Physiol. 318:E357-E370.
Kiens, B. (2006). Skeletal muscle lipid metabolism in exercise and insulin resistance. Physiol Rev 86:205-243.
Kiens, B., and E.A. Richter (1998). Utilization of skeletal muscle triacylglcerol during postexercise recovery in humans. Am. J. Physiol. 275:E332-E337.
Kimber, N.E., G.J.F. Heigenhauser, L.L. Spriet, and D.J. Dyck (2003). Skeletal muscle fat and carbohydrate metabolism during recovery from glycogen-depleting exercise in humans. J. Physiol. 548:919-927.
Larson-Meyer, D.E., B.R. Newcomer, and G.R. Hunter (2002). Influence of endurance running and revovery diet on intramyocellular lipid content in women: a 1H NMR study. Am. J. Physiol. 282:E95-E106.
MacPherson, R.E., and S.J. Peters (2015). Piecing together the puzzle of perilipin proteins and skeletal muscle lipolysis. Appl. Physiol. Nutr. Metab. 40:641-651.
Malatesta, D., C. Werlen, S. Bulfaro, X. Cheneviere, and F. Borrani (2009). Effect of high-intensity interval exercise on lipid oxidation during postexercise recovery. Med. Sci. Sports Exerc. 41:364-374.
Mole, P.A., L.B. Oscai, and J.O. Holloszy (1971). Adaptation of muscle to exercise. Increase in levels of palmityl CoA synthetase, carnitine palmityltransferase, and palmityl CoA
dehydrogenase, and in the capacity to oxidize fatty acids. J. Clin. Invest. 50:2323–2330.
Perry, C.G., G.J.F. Heigenhauser, A. Bonen, and L.L. Spriet (2008). High-intensity aerobic interval training increases fat and carbohydrate metabolic capacities in human skeletal muscle. Appl. Physiol. Nutr. Metab. 33:1112-1123.
Petrick, H.L., and G.P. Holloway (2019). High intensity exercise inhibits carnitine palmitoyltransferase-I sensitivity to l-carnitine. Biochem. J. 476:547-558.
Prats, C., M. Donsmark, K. Qvortrup, C. Londos, C. Sztalryd, C. Holm, H. Galbo, and T. Ploug (2006). Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. J. Lipid Res. 47:2392-2399.
Randell, R.K., and L.L. Spriet (2020). Factors affecting fat oxidation rates in athletes. Sports Science Exchange #206 .
Randell, R.K., I. Rollo, T.J. Roberts, K J. Dalrymple, A.E. Jeukendrup, and J.M. Carter (2017). Maximal fat oxidation rates in an athletic population. Med. Sci. Sports Exerc. 49:133-140.
Romijn, J.A., E.F. Coyle, L.S. Sidossis, A. Gastaldelli, J.F. Horowitz, E. Endert, and R.R. Wolfe (1993). Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. Am. J. Physiol. 265:E380-391.
Romijn, J.A., E.F. Coyle, L.S. Sidossis, J. Rosenblatt, and R.R. Wolfe (2000). Substrate metabolism during different exercise intensities in endurance-trained women. J. Appl. Physiol. 88:1707-1714.
Sahlin, K. (2009). Control of lipid oxidation at the mitochondrial level. Appl. Physiol. Nutr. Metab. 34:382-388.
Shepherd, S.O., M. Cocks, K.D. Tipton, A.M. Ranasinghe, T.A. Barker, J.G. Burniston, A.J.M. Wagenmakers, and C.S. Shaw (2013). Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. J. Physiol. 591:657-675.
Shepherd, S.O., M. Cocks, K.D. Tipton, O.C. Witard, A.M. Ranasinghe, T.A. Barker, A.J.M. Wagenmakers, and C.S. Shaw (2014). Resistance training increases skeletal muscle oxidative capacity and net intramuscular triglyceride breakdown in type I and II fibers of sedentary males. Exp. Physiol. 99:894-908.
Smith, B.K., C.G. Perry, T.R. Koves, D.C. Wright, J.C. Smith, P.D. Neufer, D.M. Muoio, and G.P. Holloway (2012a). Identification of a novel malonyl-CoA IC50 for CPT-1: Implications for predicting in vivo fatty acid oxidation rates. Biochem. J. 448:13–20.
Smith, B.K., A. Bonen and G.P. Holloway (2012b). A dual mechanism of action for skeletal muscle FAT/CD36 during exercise. Exerc. Sport Sci. Rev. 40:211-217.
Spriet, L.L. (2012). The metabolic systems: Lipid metabolism. In: Farrell, P.A., M.J. Joyner, and V.J. Caiozzo, (eds). Advanced Exercise Physiology, 2nd Ed. W. Lippincott, Wilkins. Philadelphia, PA, USA. pp. 392-407.
Spriet, L.L. (2014). New insights into the interaction of carbohydrate and fat metabolism during exercise. Sports Med. 44:S87-S96.
Stefanyk, L.E., A. Bonen, and D.J. Dyck (2012). Insulin and contraction-induced movement of fatty acid transport proteins to skeletal muscle transverse tubules is distinctly different
than to the sarcolemma. Metabolism 61:1518–1522.
Stellingwerff, T., H. Boon, R.A. Jonkers, J.M. Senden, L.L. Spriet, R. Koopman, and L.J. van Loon (2007). Significant intramyocellular lipid use during prolonged cycling in endurance-trained males as assessed by three different methodologies. Am. J. Physiol. 292:E1715-1723.
Talanian, J.L., G.P. Holloway, L.A. Snook, G.J.F. Heigenhauser, A. Bonen, and L.L. Spriet (2010). Exercise training increases sarcolemmal and mitochondrial fatty acid transport proteins in human skeletal muscle. Am. J. Physiol. 299:E180-188.
Turcotte, L., B. Kiens, and E.A. Richter (1991). Saturation kinetics of palmitate uptake in perfused skeletal muscle. FEBS Lett. 279:327–329.
Turcotte, L.P., E.A. Richter, and B. Kiens (1992). Increased plasma FFA uptake and oxidation during prolonged exercise in trained vs. untrained humans. Am. J. Physiol. 262:E791–E799.
Turcotte, L.P., J.R. Swenberger, M.Z. Tucker, A.J. Yee, G. Trump, J.J. Luiken, and A. Bonen
(2000). Muscle palmitate uptake and binding are saturable and inhibited by antibodies to FABP(PM). Mol. Cell. Biochem. 210:53–63.
van Loon, L.J., P.L. Greenhaff, D. Constantin-Teodosiu, W.H. Saris and A.J. Wagenmakers (2001). The effects of increasing exercise intensity on muscle fuel utilisation in humans. J. Physiol. 536: 295-304.
Watt, M.J., G.J.F. Heigenhauser, D.J. Dyck, and L.L. Spriet (2002). Intramuscular triacylglycerol, glycogen and acetyl group metabolism during 4 h of moderate exercise in man. J. Physiol. 541:969-978.






