PONTOS-CHAVE
- A desidratação (> 2% de redução na massa corporal) pode prejudicar a performance no exercício e a recuperação.
- A regulação do volume celular é influenciada pelo estado de hidratação e contração da musculatura esquelética.
- O estresse térmico intenso durante o exercício pode comprometer a estrutura e função muscular.
- Os efeitos da desidratação no dano muscular induzido pelo exercício (DMIE) não foram examinados em sua maioria, mas alguns indícios sugerem que a desidratação pode exacerbar o DMIE e prolongar a recuperação.
- Os mecanismos propostos para os efeitos adversos da desidratação no DMIE podem incluir alterações no volume celular e no fluxo iônico, ruptura da membrana celular, estímulo da contração dos ligamentos prejudicado, redução do fluxo sanguíneo na musculatura esquelética, modificação das propriedades das células vermelhas e/ou intensificação da sinalização mal adaptativa.
INTRODUÇÃO
A desidratação durante os treinos e competições pode não apenas dificultar a performance no exercício, mas também prolongar a recuperação de uma sessão anterior de exercícios. A recuperação também é influenciada pela quantidade de dano muscular induzido pelo exercício (DMIE) que ocorre quando as propriedades estruturais e funcionais (exemplo, contrátil) da musculatura esquelética são interrompidas. Isto é particularmente relevante aos atletas e profissionais da saúde porque a recuperação é um componente crítico da performance, especialmente quando diversas sessões de treinamentos ou eventos competitivos são realizados em um curto período de tempo.
Os efeitos da desidratação na performance do exercício foram estudados extensivamente (para revisão veja Cheuvront & Kenefick, 2014). No entanto, os efeitos da desidratação na extensão do DMIE e consecutivo perfil de recuperação não foram examinados em sua maioria. Algumas evidências sugerem que a desidratação afeta negativamente os marcadores de recuperação, como as medidas de desempenho funcional ou a percepção subjetiva da dor e sensibilidade muscular (Cleary et al., 2005; Ozkan & Ibrahim, 2016; Paik et al., 2009; Seifert et al., 2005). Além disso, diversos mecanismos foram propostos para explicar o papel da desidratação no DMIE, mas estudos em seres humanos são limitados. Entender as variáveis que podem acelerar o tempo de recuperação e otimizar as estratégias de recuperação pode resultar em uma vantagem competitiva aos atletas. Portanto, o objetivo deste artigo do Sports Science Exchange é discutir o papel da desidratação na extensão e duração do DMIE, do nível celular ao corpo inteiro.
CONCEITOS BÁSICOS: DESIDRATAÇÃO INDUZIDA PELO EXERCÍCIO E DANO MUSCULAR
DESIDRATAÇÃO INDUZIDA PELO EXERCÍCIO
Definições. A desidratação tem sido examinada desde o século 17 e é geralmente entendida pelo processo de perda de água corporal. A hipohidratação se refere ao estado de deficiência de água e a reidratação é o processo de transição entre os estados de hipohidratação e euhidratação. Nesta revisão, a desidratação irá se referir a perda de líquido intracelular já que essa é a principal forma de desidratação induzida pela transpiração. Já que o suor é hipotônico em relação ao sangue, as perdas de suor aumentam a osmolaridade do plasma e reduzem o volume sanguíneo, que resulta em estressores hiperosmóticos e hipovolêmicos (Sawka, 1992).
Mesmo que o padrão ouro para a determinação da água corporal total (ACT) seja frequentemente referenciado como a diluição de isótopo (óxido de deutério), a desidratação é comumente medida em função da perda de massa corporal (Cheuvront & Kenefick, 2014). As perdas de água que excedem 2% da massa corporal são normalmente indicadas pela osmolaridade plasmática elevada, volume plasmático reduzido e aumento nas concentrações de biomarcadores da urina (Cheuvront & Kenefick, 2014). Enquanto as medidas de massa corporal são frequentemente aceitáveis na área como um indicador do estado de hidratação, medir as alterações dos líquidos nas células musculares pode fornecer uma avaliação melhor dos possíveis mecanismos associados com o dano muscular secundário à desidratação. Atualmente, medir a alteração de líquidos nas células não é possível em ambientes de campo. Portanto, essa revisão irá resumir os achados em laboratório, na tentativa de traduzir os dados experimentais em recomendações práticas em relação ao possível impacto da desidratação no DMIE e recuperação.
Alteração de líquidos e Detecção do Volume Celular.
Durante o exercício ou estresse térmico ambiental, a transpiração é iniciada para prevenir aumentos excessivos na temperatura corporal (TC). Dependendo do nível de desidratação, cerca de 10% da ACT (água corporal total) é perdida pelo plasma, 40-60% do líquido intersticial (LIS), e 30-50% do líquido intracelular (LIC) (Costill et al., 1976). No entanto, a extensão da perda de água de compartimentos de tecidos específicos não é bem entendida e pode depender de diversos fatores, incluindo o estado de aclimatação e também a maneira como a desidratação é induzida (passivamente pelo estresse térmico, pelo exercício isoladamente, uma combinação de ambiente e exercício, ou farmacologicamente) (Kozlowski & Saltin,1964; Sawka, 1992).
De maneira geral, o volume celular é bem mantido pelo movimento dos líquidos controlados pelos gradientes osmóticos (Sawka, 1992) e bombas iônicas (Senay & Pivarnik, 1985). Durante o exercício, as células musculares são desafiadas a manter o volume apesar das grandes flutuações na demanda metabólica, potencial de membrana e fluxo sanguíneo (Usher-Smith et al., 2009). Nos exercícios de intensidade moderada e alta, a água intracelular se move para fora do músculo esquelético não-contrátil e outros tecidos inativos, enquanto na musculatura esquelética contrátil há um fluxo concreto de líquidos pobre em solutos que se move para dentro da musculatura esquelética, aumentando a osmolaridade plasmática. Posteriormente, as células da musculatura esquelética não-contrátil apresentam uma perda de volume celular ou encolhimento, enquanto as células contráteis apresentam um aumento no volume celular na tentativa de obter um equilíbrio osmótico (Lindinger et al., 2011).
As alterações no volume celular são principalmente detectadas pelos osmorreceptores, neurônios especializados que detectam a osmolaridade e codificam esta informação como sinais elétricos para serem enviados ao hipotálamo (Bourque, 2008). Estes sensores de volume são acoplados aos mecanismos que causam alterações nas partículas osmóticas da membrana (Toft-Bertelsen et al., 2018). Durante a desidratação celular (encolhimento celular) ambos os receptores cerebrais e periféricos contribuem na manutenção do balanço hídrico (Bourque, 2008). Os mecanismos exatos pelos quais as células detectam o inchaço ou encolhimento são desconhecidos, mas hipoteticamente são relacionados com os canais TRPV (uma família dos canais de cátions vanilóide, com receptores de potencial transitório) (Bourque, 2008). A manutenção do volume celular é essencial para a vitalidade da célula e mudanças drásticas no volume da célula causadas pela desidratação podem afetar negativamente a função da musculatura esquelética e gerar um possível aumento no DMIE.
DANO MUSCULAR INDUZIDO PELO EXERCÍCIO
A quebra e remodelação das fibras da musculatura esquelética são necessárias para a obtenção das adaptações aos treinos e aumento da performance no exercício. Teorias mecânicas do DMIE sugerem que após exercícios em que não há costume por parte do indivíduo ou as contrações excêntricas repetitivas de grande força, miofilamentos são alongados e os sarcômeros sofrem um desalinhamento ou “estalo” (Morgan & Allen, 1999). Desta forma, o processo de acoplamento excitação-contração é prejudicado pela ruptura do sarcômero, dano miofibrilar, alterações na permeabilidade da membrana e abertura dos canais sensíveis pelo estiramento (Ebbeling & Clarkson, 1989).
O dano estrutural característico associado com a atividade muscular excêntrica pode ser o resultado do fluxo de cálcio através de canais ativados por tensão (Ebbeling & Clarkson, 1989). Estes canais podem ser ativados pela falha nos estoques intracelulares de cálcio no retículo sarcoplasmático, no sistema de túbulos-T ou do sarcolema, seguido pela ativação das vias proteolíticas e lipolíticas, especialmente através da ativação do sistema calpaína (Lieber, 2010). A ativação do sistema calpaína resulta na hidrólise seletiva ou ruptura na rede de filamentos intermediários, impedindo os músculos de desenvolver tensão e limitando a produção de força. Além disso, o dano muscular cria uma resposta inflamatória distinta que leva a invasão de neutrófilos e macrófagos, ocorrendo simultaneamente ao reparo muscular e processo de regeneração (Tidball, 2005). As fibras sujeitas a este estresse podem ser eliminadas ou sofrerem necrose e se regeneram pela via das células satélites, apesar de haver fortes evidências sugerindo que os tecidos possam não sofrer necrose de fato, mas ao invés disso, ocorrer a síntese e remodelagem (Owens et al., 2019). A consequência deste processo é bem reconhecida como o atraso no início da dor e sensibilidade muscular (DOMS), apresentando-se como percepção da dor muscular e redução na capacidade de exercícios, 24-48 horas após o evento de origem da lesão. Após este ciclo de lesão e reparo, a musculatura apresenta maior capacidade para suportar uma futura pressão e o tempo de recuperação menor, efeito conhecido como “efeito da carga repetida” (Nosaka & Clarkson, 1995).
Os modelos experimentais em seres humanos do DMIE e DOMS geralmente incluem contrações musculares excêntricas repetitivas como corrida morro abaixo ou corrida de grande extensão, saltos, intervalos com exercícios de alta intensidade ou resistência com ênfase na fase excêntrica. Apesar da atividade física ser uma combinação das contrações musculares concêntricas, excêntricas e isométricas, estes modelos utilizam as contrações musculares excêntricas porque o DMIE é predominantemente demonstrado após contrações excêntricas em comparação com as contrações musculares concêntricas (Faulkner et al., 1993; Fridén et al., 1986). A recuperação dos exercícios excêntricos pode ser medida tanto funcionalmente (produção de força, variação do movimento), biomecanicamente (marcadores na circulação de dano muscular ou histologia) e subjetivamente (percepção da sensibilidade ou dor muscular). O DMIE está associado com perda de força e percepção da dor muscular, e elevação das enzimas musculares circulantes ou proteínas (exemplo, creatina quinase (CK), mioglobina). Apesar de não apresentar limitações, estas medidas são comumente utilizadas para indicar a severidade e tempo da lesão muscular. Um declínio na força muscular é uma das medidas indiretas mais confiáveis de DMIE, enquanto a classificação da dor e sensibilidade muscular, as proteínas circulantes e a histologia (apesar da medida direta) poderem ser utilizadas criteriosamente (Warren et al., 1999). As proteínas circulantes do dano muscular, como a CK e a mioglobina, retratam um padrão de elevação consistente ao longo do período de 2-6 dias, e sua aparição no sangue é atribuída ao aumento na permeabilidade da membrana (Lieber, 2010). No entanto, perdas de força diretas surgem mais imediatamente e têm um padrão temporal diferente do que os marcadores comumente utilizados (exemplo, CK, lactato desidrogenase LDH, transaminase glutâmica-oxalacética, fragmentos de cadeia pesada de miosina lenta, e mioglobina) (Hyldahl & Hubal, 2014). Apesar de diferentes populações de indivíduos ou modos diferentes de exercício terem sido utilizados para induzir o DMIE, padrões similares de perda de força, dor, sensibilidade, disfunção musculares e biomarcadores são aparentes nos modelos (Figura 1).
Devido aos descréscimos associados ao performance e ao aumento do tempo de recuperação, o DMIE foi tradicionalmente considerado como sendo negativo. No entanto, estas curtas reduções de performance são o reflexo do processo inflamatório que ocorre na musculatura esquelética e o consequente aumento no turnover de proteínas, necessários para as adaptações de longo prazo aos exercícios (Lieber, 2010). O máximo estímulo para maximizar as adaptações de performance e otimizar a recuperação é ainda desconhecido, e poucas pesquisas foram realizadas para entender as variáveis que podem modificar a severidade do DMIE, como a desidratação. Evidências descrevendo a influência da desidratação no dano muscular ou recuperação do exercício excêntrico são espaçadas e inconclusivas (Cleary et al., 2005, 2006; Ozkan & Ibrahim, 2016; Yamamoto et al., 2008). Considerando que a desidratação amplifica os efeitos do estresse osmótico, da hipertermia e da disfunção da musculatura esquelética, o conceito de que a desidratação pode prolongar a recuperação do exercício deveria ser mais examinado.
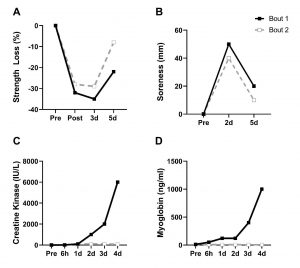
Figura 1. O tempo característico e padrão de recuperação de (A) perda de força (perda de força muscular isométrica máxima, com valores de porcentagem no pré-exercício), (B) sensibilidade (escala análoga visual em linha de 50mm), (C) atividade plasmática da creatina quinase (IU/l), e (D) atividade plasmática da mioglobina (ng/ml), após duas sessões de exercício separadas por quatro semanas de recuperação. Reproduzido de Hirose et al., 2004; Hubal et al., 2008; Hyldahl & Hubal, 2014, com permissão).
Tradução da figura:
A – Perda de Força (%)/Pré / Pós
B – Sensibilidade (mm) /Pré
C – Creatina Quinase (IU/l) /Pré
D – Mioglobina (ng/ml) /Pré
Sessão 1
Sessão 2
MECANISMOS PARA AUMENTO DO DANO DA MUSCULATURA ESQUELÉTICA COM A DESIDRATAÇÃO
CONTEXTO: PERFORMANCE E RECUPERAÇÃO
O papel da desidratação na performance do exercício foi extensivamente estudado sob uma variedade de condições ambientais e fisiológicas. A restrição de líquidos durante o exercício dificulta a performance, particularmente em testes de exercício de resistência (Cheuvront & Kenefick, 2014). Os mecanismos propostos para o decréscimo na performance de resistência estão associados com a redução no volume plasmático, no preenchimento cardíaco e no volume sistólico (Cheuvront & Kenefick, 2014). Estes ajustes culminam na redução do fluxo sanguíneo na musculatura contrátil que altera o metabolismo muscular e impede a termorregulação, especialmente em ambientes quentes. Teoricamente, estes mesmos ajustes poderiam intensificar o DMIE e prolongar a recuperação após uma sessão de exercícios.
Apesar do papel preciso da desidratação aguda no DMIE ainda não estar claro, a reidratação tem um papel importante na recuperação do exercício. A reidratação foi demonstrada na melhora da performance no exercício e é especialmente importante após exercícios extensos em condições quentes e úmidas (McCartney et al., 2017). Isto sugere que a hidratação adequada durante o exercício pode também ter um papel importante na recuperação. A hidratação apropriada pode ajudar a neutralizar possíveis processos que podem influenciar o DMIE, como os efeitos independentes e concomitantes do estresse osmótico, edema na fibra muscular e hipertermia.
ESTRESSE OSMÓTICO
O estresse osmótico pode ser considerado uma disfunção fisiológica que é causada por uma alteração repentina na concentração de solutos ao redor da célula. Durante o exercício e estresse térmico, as fibras musculares são expostas a diversas alterações dos líquidos, intra e extracelulares, que podem resultar no estresse osmótico. Em relação ao corpo inteiro, a desidratação em geral reduz a pressão de perfusão para a musculatura esquelética, reduzindo o fluxo sanguíneo neste tecido e colocando a musculatura em risco ao dano relacionado a isquemia (González-Alonso et al., 1998).
No nível celular, a musculatura esquelética sofre alterações acentuadas temporárias no volume celular (inchaço seguido de encolhimento), sinalizando espécies reativas de oxigênio (EROs) (Laitano et al., 2012). Estas alterações sucessivas nas células podem comprometer a função da musculatura esquelética, potencialmente através da regulação do movimento de líquidos nas células. Este sinal é provavelmente exagerado quando a desidratação é concomitante com a contração muscular excêntrica repetitiva e tem o potencial de aumentar o dano muscular ou prolongar a recuperação. A desidratação pode alterar o balanço redox pelos efeitos da reperfusão isquêmica do fluxo sanguíneo na musculatura esquelética (Laitano et al., 2012). Em maiores níveis de desidratação (4-5% de perda de massa corporal), a maior viscosidade sanguínea aumenta a produção de EROs pelo aumento do estresse vascular absoluto e da rigidez das células vermelhas (Ahmadizad et al., 2006; Senay & Pivarnik, 1985). A maior geração de EROs na musculatura esquelética pode lesionar o sarcolema, o citoesqueleto e o DNA, assim como gerar um alinhamento abaixo do ideal das unidades de contração da musculatura esquelética, dificultando a contração muscular (Steinbacher & Eckl, 2015) (Figure 2). Especialmente, a produção de EROs é necessária para adaptação aos estressores como o exercício, a hipertermia e a desidratação, enfatizando que a produção de EROs não deve ser completamente evitada (King et al., 2016).
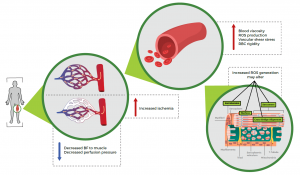
Figura 2. Possíveis mecanismos para o aumento no dano do músculo esquelético com a desidratação. BF, fluxo sanguíneo; EROs, espécie reativa de oxigênio; RBC, células vermelhas do sangue.
Tradução da Figura:
↑ Viscosidade sanguínea / Produção de EROs /Estresse vascular absoluto /Rigidez das RBCs
Maior geração de Eros pode alterar /em verde: Sarcolema /Sarcômero / Núcleo / Pontes cruzadas de miosinas/ em cinza: Sarcoplasma/ Miofibrilas / Miofilamentos/ Tríade /Retículo sarcoplasmático/ Mitocôndria / Túbulo-T
↑ Maior isquemia
↓ Redução do fluxo sanguíneo para a musculatura / Redução da pressão de perfusão
EDEMA DA FIBRA MUSCULAR
Tanto a hipertermia como o exercício podem resultar na perda de água do corpo inteiro por evaporação, assim como no inchaço da fibra muscular. Durante as contrações do exercício que provocam fadiga, as alterações na pressão osmótica são a causa principal do edema muscular, com um aumento documentado no tamanho da fibra muscular em até 35%, que pode permanecer por até uma hora após o exercício (Usher-Smith et al., 2009). Além disso, estudos com biópsia da musculatura demonstraram aumentos no conteúdo de água intracelular (15%) e volume celular (15-20%), após exercício máximo (Sjogaard, 1983; Sjogaard et al., 1985). O inchaço da fibra muscular é causado pelas elevações no conteúdo de solutos durante o exercício, onde a quebra da fosfocreatina, elevações no lactato e H+, assim como alterações nos gradientes iônicos são contribuintes (Hoffmann et al., 2009). As contrações musculares excêntricas parecem ser a causa para o inchaço em maiores quantidades de fibras, provavelmente um resultado direto do bombeamento disfuncional da membrana que leva à redução do deslocamento de sódio e consecutivo edema nas fibras musculares (Fridén et al., 1988). Frequentemente esquecido, o inchaço das fibras musculares pode ser atribuído ao aumento induzido pelas contração na produção metabólica de água, já que a água é produzida com cada grama de carboidrato (0,6 ml de água), ou gordura (1,1 ml de água) oxidados (Maughan et al., 2007).
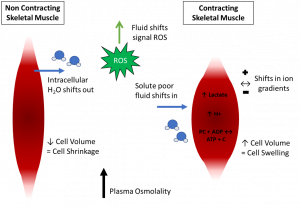
Figura 3. Um resumo das consequências da desidratação no movimento de líquidos durante a contração muscular. EROs, espécies reativas de oxigênio.
Tradução da figura:
Músculo esquelético não-contrátil
Músculo esquelético contrátil
↑Movimento de líquidos/ sinal de EROs
H2O intracelular sai
↓Volume celular = encolhimento da célula
Líquido pobre em solutos entra
Alterações nos gradientes iônicos
↑Volume celular = edema da célula
↑ Osmolaridade plasmática
Além disso, modelos de cultura celular demonstram que a hipertermia por si só causa um inchaço em uma variedade de células (Gervais et al., 2003). Este inchaço celular está associado com aumentos irreversíveis no espaço entre as membranas dos túbulos-T e do retículo sarcoplasmático. No sarcolema, a homeostase do cálcio está alterada pelos aumentos na permeabilidade do cátion, que permite o fluxo de cálcio extracelular para as fibras do músculo esquelético, possivelmente aumentando a resposta imunológica e prejudicando a glicogenólise (Clarkson & Hubal, 2002). A musculatura esquelética é particularmente suscetível à falha celular porque ela conta com solutos intracelulares para o estímulo da contração dos ligamentos (exemplo, cálcio) (Usher-Smith et al., 2009).
A suscetibilidade para a desidratação e DMIE também parece ser dependente da fibra muscular. A desidratação pode principalmente afetar fibras de contração rápida (Farhat et al., 2018), que são também prejudicadas pelo exercício excêntrico (Vijayan et al., 2001) possivelmente criando um efeito adicional de dano muscular. No entanto, outras pesquisas sugerem um efeito protetor na hiperosmolaridade hipertérmica (desidratação simulada) na lesão do sarcolema, que também foi específica ao tipo de fibra (Laitano et al., 2018). Dado que estes estudos foram realizados em modelos com camundongos, existe a necessidade em determinar se estas mesmas respostas aconteceriam em humanos.
É importante ressaltar que uma pequena quantidade de inchaço parece melhorar a função contrátil muscular, enquanto o edema severo, como o visto no choque osmótico, tem o potencial de desprender os túbulos transversais da superfície da membrana (Usher-Smith et al., 2009). Perturbações menores no volume celular podem também alterar a estrutura da célula muscular e sua função afetando a arquitetura da célula, organelas e a membrana celular (Usher-Smith et al., 2009). O volume celular é também um fator importante na regulação do turnover de proteínas pela sinalização da síntese de proteínas durante o inchaço celular e a degradação de proteínas durante o encolhimento celular (Haussinger et al., 1993).
INFLUÊNCIA DA HIPERTERMIA
Independentemente do estado de hidratação, modelos com camundongos sugerem que a hipertermia tem uma forte influência no perfil de danos da musculatura esquelética e pode aumentar a suscetibilidade ao dano induzido pelo estiramento (Hill, 1972; Oliver et al., 2008). As temperaturas musculares mostraram alcançar mais que 40ºC (104ºF) durante exercícios intensos (Morris et al., 2005), o que pode aumentar a tensão passiva. Uma maior tensão passiva coloca a musculatura em maiores riscos de dano do sarcômero com maior detrimento na perda de força, dor, sensibilidade da musculatura, e atividade da CK (McHugh et al., 1999). Além disso, a hipertermia por si só foi demonstrada causar uma variedade de alterações na musculatura esquelética como desalinhamento, estiramento da estrutura da trama muscular, falha na liberação de cálcio, lesão do sarcolema e redistribuição de eletrólitos que aumentam a osmolaridade extracelular e tensão muscular (Hargreaves & Febbraio, 1998). Um mecanismo secundário de lesão através de proteases e fosfolipases pode impedir a liberação de cálcio mediada por cálcio no retículo sarcoplasmático desafiando a contração muscular (Owens et al., 2019).
Curiosamente, quando o efeito independente da hipertermia foi isolado através de diatermia por ondas curtas, o calor não alterou o dano funcional da musculatura ou afetou o perfil de biomarcadores após exercício excêntrico (Castellani et al., 2016). Hillman et al. (2011) isolou os efeitos independentes do estresse térmico ambiental e desidratação no estresse oxidativo, concluindo que a desidratação induzida pelo exercício pode aumentar o estresse oxidativo, enquanto a euhidratação é protetora deste efeito independente das condições ambientais. Não houve efeitos independentemente do estresse térmico ambiental além das elevações esperadas na taxa cardíaca e TC.
A DESIDRATAÇÃO PODE AUMENTAR O DANO MUSCULAR E PROLONGAR A RECUPERAÇÃO?
Entender os elementos críticos para a recuperação do exercício não é apenas importante para os atletas e profissionais da saúde que os auxiliam, mas também para a população em geral. Apesar de haver alguns mecanismos plausíveis pelos quais a desidratação pode aumentar a extensão do DMIE, e portanto, prolongar a recuperação, pesquisas atuais são limitadas e variadas.
Quando o dano muscular foi induzido através de exercícios de resistência que provocam a fadiga (agachamento), precedido por exercícios que causaram estresse térmico e a privação de água, elevações nos biomarcadores sanguíneos como o lactato, CK e mioglobina foram similares entre os grupos de desidratação e euhidratação até 48 horas após o exercício (Yamamoto et al., 2008). De maneira oposta, após diversas sessões de prática de ski nos Alpes, a CK, mioglobina, e o cortisol foram todos significativamente elevados quando o líquido não foi resposto durante a atividade (Seifert et al., 2005). Achados similares foram demonstrados quando praticantes de luta livre utilizaram uma variedade de métodos não padronizados de indução da desidratação de 1-7 dias, anteriormente à competição. Os lutadores desidratados (de acordo com a osmolaridade plasmática antes da competição) tiveram maiores níveis de biomarcadores sanguíneos (aspartato aminotransferase, nitrogênio da ureia sanguínea, LDH e CK) que os grupos euhidratados (Ozkan & Ibrahim, 2016). Apesar destes estudos terem sido capazes de medir biomarcadores sanguíneos de desidratação e dano muscular, eles tiveram falta de indicadores funcionais de dano muscular, como o resultado de força e percepção da sensibilidade e dor muscular).
Como discutido acima, a hipertermia é conhecida por exacerbar o dano muscular, portanto é importante considerar o impacto ambíguo da TC quando interpretar os efeitos da desidratação no DMIE e DOMS. Um estudo importante de Cleary et al. (2005) demonstrou que os sintomas de DOMS (dor e sensibilidade) foram exacerbados quando a desidratação foi induzida através da restrição de líquidos e estresse térmico ambiental anteriormente à corrida morro abaixo em condições termo-neutras. No entanto, um estudo subsequente não encontrou impacto na DOMS quando a TC dos indivíduos retornou aos “níveis normotérmicos ou pré-exercício” anterior ao início da corrida (Cleary et al., 2006). De maneira similar, Greiwe et al. (1998) demonstrou que quando indivíduos descansaram após o estresse térmico passivo (~4% de redução na massa corporal) antes de realizar uma série de medidas de força, a desidratação não teve influência nas concentrações plasmáticas de mioglobina ou potássio, torque de pico ou tempo para a fadiga. Contudo, o delineamento experimental destes estudos não isolaram verdadeiramente os efeitos da hipertermia ou da desidratação.
CONCLUSÕES E CONSIDERAÇÕES
No geral, há mecanismos plausíveis pelos quais a desidratação durante o exercício extenuante pode aumentar a extensão do DMIE, e portanto, prolongar a recuperação. No entanto, estudos que examinaram o efeito do estado de hidratação no dano muscular ou na recuperação forneceram resultados ambíguos e são limitados pelo delineamento experimental ou questões metodológicas. Investigadores tentaram isolar os efeitos independentes da desidratação, resultante do estresse térmico ambiental ou da hipertermia induzida pelo exercício, com diversos graus de sucesso. Os efeitos independentes do exercício podem confundir a interpretação dos resultados já que eles causam aumento na produção de calor, alteração de líquidos e produção de EROs, tornando o isolamento destas variáveis desafiadoras em modelos humanos. Apesar de estudos em camundongos serem relevantes para responder estas questões, os achados podem ter falta de tradução para os seres humanos. Mesmo que estudos em humanos atualmente apresentem problemas metodológicos, é possível que a desidratação aumente a severidade do dano muscular e prolongue a recuperação, especialmente em conjunto com a hipertermia.
O QUE NÓS SABEMOS?
- A desidratação pode afetar negativamente a performance do exercício de resistência, enquanto a reidratação foi mostrada melhorar as sessões de exercícios subsequentes.
- Algumas das perturbações fisiológicas responsáveis pelo decréscimo na performance durante a desidratação, como o fluxo sanguíneo reduzido para a musculatura contrátil, as alterações no metabolismo muscular e impedimentos na termorregulação, podem também contribuir para o DMIE.
- O DMIE é causado por contração muscular excêntrica repetitiva resultando na perda de função musculoesquelética e DOMS.
- Independente da desidratação, a hipertermia causa alterações na musculatura esquelética que podem aumentar a suscetibilidade para o DMIE.
O QUE MAIS PRECISAMOS SABER?
- O efeito independente da desidratação no DMIE é desconhecido. Testes de exercícios bem controlados em humanos com metodologia consistente devem ser realizados antes da realização de recomendações conclusivas.
- Enquanto o DMIE é principalmente a consequência das contrações excêntricas da musculatura esquelética, o efeito do estado de hidratação em outros tipos de contrações musculoesqueléticas isoladas (concêntrica, isométrica) é desconhecido.
- Elementos fundamentais do delineamento experimental que devem ser padronizados nos estudos futuros incluem: o modo de indução da desidratação e DMIE; o período de tempo entre a indução da desidratação, DMIE e medições subsequentes, e os momentos em que as amostras sanguíneas são coletadas após a intervenção; e a necessidade de amostragem da musculatura esquelética humana.
- Como a desidratação modifica o DMIE e em qual extensão, é desconhecido. No entanto, os possíveis mecanismos podem ter origem nos efeitos do estresse osmótico, hipertermia e inchaço das fibras musculares.
- O nível de desidratação necessária para influenciar o DMIE e a duração da recuperação ainda precisa ser determinado.
- Estudos sugerem que o estado de hidratação é uma variável importante que deve ser considerada quando se tenta minimizar o DMIE e maximizar a recuperação, apesar de mais pesquisas serem necessárias.
NOTAS
Os autores gostariam de agradecer o Dr. Orlando Laitano e Dra. Rebecca Randell por sua assistência na revisão e preparo deste trabalho. Michelle King e Lindsay Baker são colaboradoras do Instituo Gatorade de Ciências dos Esportes, uma divisão da PepsiCo, Inc. Os pontos de vistas expressos neste artigo são dos autores e não necessariamente refletem a posição ou política da PepsiCo, Inc.
REFERÊNCIAS
Ahmadizad, S., M.S. El-Sayed. and D.P. MacLaren (2006). Effects of water intake on the responses of haemorheological variables to resistance exercis. Clin. Hemorheol. Microcirc. 35:317-327.
Bourque, C.W. (2008). Central mechanisms of osmosensation and systemic osmoregulation. Nat. Rev. Neurosci. 9:519-531.
Castellani, J., E.J. Zambraski, M. . Sawka, and M.L. Urso (2016). Does high muscle temperature accentuate skeletal muscle injury from eccentric exercise? Physiol. Rep. 4:e12777.
Cheuvront, S.N., and R.W. Kenefick (2014). Dehydration: physiology, assessment, and performance effects. Compr. Physiol. 4:257-285.
Clarkson, P.M., and M.J. Hubal (2002). Exercise-induced muscle damage in humans. Am. J. Phys. Med. Rehabil. 81(Suppl):S52-S69.
Cleary, M.A., L.A. Sweeney, Z.V. Kendrick, and M.R. Sitler (2005). Dehydration and symptoms of delayed-onset muscle soreness in hyperthermic males. J. Athl. Train. 40:288-297.
Cleary, M.A., M.R. Sitler, and Z.V. Kendrick (2006). Dehydration and symptoms of delayed-onset muscle soreness in normothermic men. J. Athl. Train. 41:36-45.
Costill, D.L., R. Coté, and W. Fink (1976). Muscle water and electrolytes following varied levels of dehydration in man. J. Appl. Physiol. 40:6-11.
Ebbeling, C B., and P.M. Clarkson (1989). Exercise-induced muscle damage and adaptation. Sports Med. 7:207-234.
Farhat, F., J.F. Grosset, and F. Canon (2018). Water deprivation decreases strength in fast twitch muscle in contrast to slow twitch muscle in rat. Acta Physiol. 224:e13072.
Faulkner, J.A., S.V. Brooks, and J.A. Opiteck (1993). Injury to skeletal muscle fibers during contractions: conditions of occurrence and prevention. Phys. Ther. 73:911-921.
Fridén, J., P.N. Sfakianos, and A.R. Hargens (1986). Muscle soreness and intramuscular fluid pressure: comparison between eccentric and concentric load. J. Appl. Physiol. 61:2175-2179.
Fridén, J., P.N. Sfakianos, A.R. Hargens, and W.H. Akeson (1988). Residual muscular swelling after repetitive eccentric contractions. J. Orthop. Res. 6:493-498.
Gervais, P., I. Martinez de Maranon, C. Evrard, E. Ferret, and S. Moundanga (2003). Cell volume changes during rapid temperature shifts. J. Biotechnol. 102:269-279.
González-Alonso, J., J.A. Calbet, and B. Nielsen (1998). Muscle blood flow is reduced with dehydration during prolonged exercise in humans. J. Physiol. 513:895-905.
Greiwe, J.S., K.S. Staffey, D.R. Melrose, M.D. Narve, and R.G. Knowlton (1998). Effects of dehydration on isometric muscular strength and endurance. Med. Sci. Sports . 30:284-288.
Hargreaves, M., and M. Febbraio (1998). Limits to exercise performance in the heat. Int. J. Sports Med. 19(Suppl 2):S115-S116.
Haussinger, D., E. Roth, F. Lang, and W. Gerok (1993). Cellular hydration state: an important determinant of protein catabolism in health and disease. Lancet 341:1330-1332.
Hill, D.K. (1972). Resting tension and the form of the twitch of rat skeletal muscle at low temperature. J. Physiol. 22:161-171.
Hillman, A.R., R.V. Vince, L. Taylor, L. McNaughton, N. Mitchell, and J. Siegler (2011). Exercise-induced dehydration with and without environmental heat stress results in increased oxidative stress. Appl. Physiol. Nutr. Metab. 36:698-706.
Hirose, L., K. Nosaka, M. Newton, A. Laveder, M. Kano, J. Peake, and K. Suzuki (2004). Changes in inflammatory mediators following eccentric exercise of the elbow flexors. Exerc. Immunol. Rev. 10:75-90.
Hoffmann, E.K., I.H. Lambert, and S.F. Pedersen (2009). Physiology of cell volume regulation in vertebrates. Physiol. Rev. 89:193-277.
Hubal, M.J., T.C. Chen, P.D. Thompson, and P. M. Clarkson (2008). Inflammatory gene changes associated with the repeated-bout effect. Am. J. Physiol. 294:R1628-R1637.
Hyldahl, R.D., and M.J. Hubal (2014). Lengthening our perspective: morphological, cellular, and molecular responses to eccentric exercise. Muscle Nerve 49:155-170.
King, M.A., T.L. Clanton, and O. Laitano (2016). Hyperthermia, dehydration, and osmotic stress: unconventional sources of exercise-induced reactive oxygen species. Am. J. Physiol. 310:R105-R114.
Kozlowski, S., and B. Saltin (1964). Effect of sweat loss on body fluids. J. Appl. Physiol. 19:1119-1124.
Laitano, O., K.K. Kalsi, J. Pearson, M. Lotlikar, A. Reischak-Oliveira, and J. Gonzalez-Alonso (2012). Effects of graded exercise-induced dehydration and rehydration on circulatory markers of oxidative stress across the resting and exercising human leg. Eur. J. Appl. Physiol. 112:1937-1944.
Laitano, O., L.H. Sheikh, A.J. Mattingly, K.O. Murray, L.F. Ferreira, and T.L. Clanton (2018). Osmolality selectively offsets the impact of hyperthermia on mouse skeletal muscle in vitro. Front. Physiol. 9:1496.
Lieber, R.L. (2010). Skeletal muscle structure, function, and plasticity: The physiological basis of rehabilitation. Lippincott Williams and Wilkins, Baltimore, Maryland, USA.
Lindinger, M.I., M. Leung, K.E. Trajcevski, and T.J. Hawke (2011). Volume regulation in mammalian skeletal muscle: the role of sodium-potassium-chloride cotransporters during exposure to hypertonic solutions. J. Physiol. 589:2887-2899.
Maughan, R.J., S.M. Shirreffs, and J.B. Leiper (2007). Errors in the estimation of hydration status from changes in body mass. J. Sports Sci. 25:797-804.
McCartney, D., B. Desbrow, and C. Irwin (2017). The effect of fluid intake following dehydration on subsequent athletic and cognitive performance: a systematic review and meta-analysis. Sports Med. Open 3:13.
McHugh, M.P., D.A. Connolly, R.G. Eston, I.J. Kremenic, S.J. Nicholas, and G.W. Gleim (1999). The role of passive muscle stiffness in symptoms of exercise-induced muscle damage. Am. J. Sports Med. 27:594-599.
Morgan, D.L., and D.G. Allen (1999). Early events in stretch-induced muscle damage. J. Appl. Physiol. 87:2007-2015.
Morris, J.G., M.E. Nevill, L.H. Boobis, I.A. Macdonald, and C. Williams (2005). Muscle metabolism, temperature, and function during prolonged, intermittent, high-intensity running in air temperatures of 33 degrees and 17 degrees C. Int. J. Sports Med. 26:805-814.
Nosaka, K., and P.M. Clarkson (1995). Muscle damage following repeated bouts of high force eccentric exercise. Med. Sci. Sports Exerc. 27:1263-1269.
Oliver, S.R., V.P. Wright, N. Parinandi, and T.L. Clanton (2008). Thermal tolerance of contractile function in oxidative skeletal muscle: no protection by antioxidants and reduced tolerance with eicosanoid enzyme inhibition. Am. J. Physiol. 295:R1695-R1705.
Owens, D.J., C. Twist, J.N. Cobley, G. Howatson, and G.L. Close (2019). Exercise-induced muscle damage: What is it, what causes it and what are the nutritional solutions? Eur. J. Sport Sci. 19:71-85.
Ozkan, I., and C.H. Ibrahim (2016). Dehydration, skeletal muscle damage and inflammation before the competitions among the elite wrestlers. J. Phys. Ther. Sci. 28:162-168.
Paik, I.Y., M.H. Jeong, H.E. Jin, Y.I. Kim, A.R. Suh, S.Y. Cho, H.T. Roh, C.H. Jin, and S.H. Suh (2009). Fluid replacement following dehydration reduces oxidative stress during recovery. Biochem. Biophys. Res. Commun. 383:103-107.
Sawka, M.N. (1992). Physiological consequences of hypohydration: exercise performance and thermoregulation. Med. Sci. Sports Exerc. 24:657-670.
Seifert, J.G., R.W. Kipp, M. Amann, and O. Gazal (2005). Muscle damage, fluid ingestion, and energy supplementation during recreational alpine skiing. Int. J. Sport Nutr. Exerc. Metab. 15:528-536.
Senay, L.C., Jr., and J.M. Pivarnik (1985). Fluid shifts during exercise. Exerc. Sport Sci. Rev. 13:335-387.
Sjogaard, G. (1983). Electrolytes in slow and fast muscle fibers of humans at rest and with dynamic exercise. Am. J. Physiol. 245:R25-R31.
Sjogaard, G., R.P. Adams, and B. Saltin (1985). Water and ion shifts in skeletal muscle of humans with intense dynamic knee extension. Am. J. Physiol. 248:R190-R196.
Steinbacher, P., and P. Eckl (2015). Impact of oxidative stress on exercising skeletal muscle. Biomolecules 5:356-377.
Tidball, J.G. (2005). Inflammatory processes in muscle injury and repair. Am. J. Physiol. 288:R345-R353.
Toft-Bertelsen, T.L., B.R. Larsen, and N. MacAulay (2018). Sensing and regulation of cell volume – we know so much and yet understand so little: TRPV4 as a sensor of volume changes but possibly without a volume-regulatory role? Channels 12:100-108.
Usher-Smith, J.A., C.L. Huang, and J.A. Fraser (2009). Control of cell volume in skeletal muscle. Biol. Rev. Camb. Philos. Soc. 84:143-159.
Vijayan, K., J.L. Thompson, K.M. Norenberg, R.H. Fitts, and D.A. Riley (2001). Fiber-type susceptibility to eccentric contraction-induced damage of hindlimb-unloaded rat AL muscles. J. Appl. Physiol. 90:770-776.
Warren, G.L., D.A. Lowe, and R.B. Armstrong (1999). Measurement tools used in the study of eccentric contraction-induced injury. Sports Med, 27:43-59.
Yamamoto, L.M., D.A. Judelson, M.J. Farrell, E.C. Lee, LE. Armstrong, D.J. Casa, W.J. Kraemer, J.S. Volek, and C.M. Maresh (2008). Effects of hydration state and resistance exercise on markers of muscle damage. J. Strength Cond. Res. 22:1387-1393.




