SSE #220: PROTEÍNAS DE ORIGEM VEGETAL VERSUS ANIMAL NO AUXÍLIO AO CONDICIONAMENTO MUSCULAR
PONTOS-CHAVE:
- O aumento nas taxas de síntese de proteínas musculares após a ingestão de uma porção única (20-25 g) de proteína de origem vegetal na refeição parece ser menos robusto quando comparado com a resposta após a ingestão de uma quantidade equivalente de proteína animal.
- Considera-se que as propriedades anabólicas menores das proteínas de origem vegetal propostas sejam atribuídas a um menor conteúdo de aminoácidos essenciais em comparação com as proteínas de origem animal de alta qualidade, com muitas proteínas de origem vegetal sendo deficientes em um ou mais aminoácidos específicos, como a lisina ou metionina.
- Há uma variação considerável no conteúdo de proteína em diversas fontes vegetais de proteína e na composição de aminoácidos destas proteínas.
- O aumento nas taxas de síntese de proteínas musculares após a ingestão de uma fonte vegetal de proteína, de uma proteína de origem vegetal isolada ou concentrados destas proteínas, pode ser aprimorado pelo aumento da quantidade de proteína ingerida, pelo consumo de uma combinação de diferentes fontes vegetais de proteína ou proteínas derivadas de plantas, e/ou pela fortificação destas proteínas com o aminoácido ou aminoácidos (livres) deficientes.
- O consumo de uma quantidade definida de proteínas na forma de alimentos de origem vegetal geralmente requer uma maior quantidade de alimento, tanto em peso quanto em teor calórico, quando comparado ao consumo de uma quantidade equivalente de proteínas de origem animal de alta qualidade.
- O condicionamento muscular em atletas não precisa ser comprometido ao adotar uma dieta à base de plantas, desde que as proteínas sejam consumidas o suficiente a partir de uma grande variedade de fontes de proteínas de origem vegetal.
INTRODUÇÃO
A ingestão de proteínas estimula a síntese de proteínas dos músculos esqueléticos (Groen et al., 2015). As taxas de síntese de proteínas musculares são muito maiores quando a proteína é ingerida durante a recuperação do exercício, desta forma facilitando o condicionamento muscular (Moore et al., 2009b). A ingestão de 20 g de uma proteína de alta qualidade pode maximizar as taxas de síntese de proteínas musculares por diversas horas (Churchward-Venne et al., 2020; Moore et al., 2009a; Witard et al., 2014). A resposta da síntese de proteínas musculares à alimentação é determinada em grande parte pela quantidade de proteínas ingeridas (Churchward-Venne et al., 2020; Moore et al., 2009a; Robinson et al., 2013; Witard et al., 2014), pela digestão das proteínas e pela cinética de absorção (Boirie et al., 1997), e pela composição de aminoácidos da proteína (fonte) consumida (Tang et al., 2009; Yang et al., 2012b). A resposta da síntese de proteínas musculares à ingestão de proteínas pode, portanto, variar substancialmente entre diferentes fontes de proteínas alimentares (Gorissen et al., 2016; Tang et al., 2009; Yang et al., 2012b). A diferente resposta da síntese de proteínas musculares à alimentação depende em grande parte do aumento pós-prandial das concentrações de aminoácidos essenciais na circulação, com a concentração plasmática de leucina sendo de particular importância (Dickinson et al., 2014; Koopman et al., 2005; Rieu et al., 2006; Wall et al., 2013; Wilkinson et al., 2013). O aumento pós-prandial dos aminoácidos essenciais na circulação e o posterior aumento nas taxas de síntese de proteínas musculares são regulados em diversos níveis, ordenando a digestão de proteínas e a absorção de aminoácidos, a captação esplâncnica de aminoácidos, a perfusão pós-prandial do tecido, a captação de aminoácidos na musculatura, a ativação do mecanismo de síntese de proteínas musculares e finalmente a síntese de proteínas musculares (Groen et al., 2015; Trommelen et al., 2021a). Até o momento, a maioria dos estudos tem avaliado as taxas de síntese de proteínas musculares após a ingestão de proteínas proveniente dos laticínios (Churchward-Venne et al., 2019a; Pennings et al., 2011; Tang et al., 2007; Tipton et al., 2004; Wilkinson et al., 2018) e de carnes (Burd et al., 2015; Robinson et al., 2013).
Com a estimativa da população mundial de atingir quase 10 bilhões de pessoas até 2050, pode não mais ser possível produzir quantidades suficientes de alimentos convencionais ricos em proteínas de origem animal para atingir as crescentes demandas globais de proteínas alimentares. Isto desencadeou uma tendência de seguir na direção do consumo de uma dieta (mais) à base de plantas. Mudar para uma dieta (mais) à base de plantas irá aumentar o consumo de proteínas de origem vegetal ao invés das proteínas animais. Apesar do mercado atual já oferecer uma ampla seleção de fontes vegetais de proteínas e de proteínas isoladas ou concentrados de proteínas derivadas das plantas, há apenas poucos estudos que avaliaram a biodisponibilidade e as propriedades anabólicas das proteínas de origem vegetal in vivo em humanos (Churchward-Venne et al., 2019b; Gorissen et al., 2016; Pinckaers et al., 2021; Tang et al., 2009; Wilkinson et al., 2007; Yang et al., 2012a). Estes estudos tendem a mostrar que a ingestão das proteínas de origem vegetal, como a soja e as proteínas do trigo, não apresenta a mesma capacidade em aumentar as taxas de síntese de proteínas musculares quando comparadas com a ingestão de uma quantidade equivalente de proteínas de origem animal (Gorissen et al., 2016; Tang et al., 2009; Wilkinson et al., 2007; Yang et al., 2012a). Consequentemente, surgiram questões sobre se o consumo de uma dieta (mais) à base de plantas e de proteínas de origem vegetal ao invés das proteínas de origem animal poderia comprometer a síntese de proteínas musculares e, desta forma, impactar negativamente na saúde e na performance muscular.
BIODISPONIBILIDADE DE PROTEÍNAS
Após a ingestão de alimentos, a proteína alimentar sofre uma quebra mecânica e química em componentes menores na boca, no estômago e no intestino delgado, (Trommelen et al., 2021b) após a qual os aminoácidos podem ser absorvidos no lúmen intestinal. Uma parte significativa dos aminoácidos absorvidos será retida e metabolizada na região esplâncnica, mas a maior parte dos aminoácidos das proteínas será liberada na circulação. A avaliação quantitativa da digestibilidade das proteínas, da absorção dos aminoácidos, da captação esplâncnica e da liberação dos aminoácidos na circulação é complexa e apenas alguns estudos tentaram quantificar o processamento pós-prandial das proteínas in vivo em humanos (Groen et al., 2015). Em geral, as proteínas dos alimentos de origem vegetal não são absorvidas tão efetivamente em comparação com as proteínas dos alimentos de origem animal (Kashyap et al., 2018; 2019). A menor absorção das proteínas de origem vegetal pode ser em grande parte atribuída aos fatores antinutricionais presentes nas fontes de proteínas de origem vegetal (Sarwar Gilani et al., 2012). Quando uma proteína de origem vegetal é extraída da fonte de proteína e purificada dos fatores antinutricionais para produzir uma proteína isolada ou um concentrado de proteínas derivadas das plantas, normalmente a absorção posterior da proteína atinge níveis similares àqueles observados nas fontes convencionais de proteínas de origem animal (Gausserès et al., 1997). Isto implica que a menor absorção das fontes de proteínas de origem vegetal não é uma característica inerente da proteína em si, mas simplesmente um resultado da matriz alimentar da fonte de proteína.
Além da biodisponibilidade da proteína em geral, há muitos dados sugerindo que a taxa de absorção dos aminoácidos resulta em um fator independente que modula a resposta da síntese de proteínas musculares à alimentação (Gorissen et al., 2020; Koopman et al., 2009b; Pennings et al., 2011). Há poucos dados disponíveis sobre a cinética de absorção dos aminoácidos após a ingestão de fontes de proteínas de origem vegetal, de proteínas isoladas ou concentrados de proteínas derivadas de plantas. Ao contrário de muitas fontes vegetais de proteínas, a ingestão de proteínas isoladas ou concentrados destas proteínas derivadas de plantas é geralmente seguida por um rápido aumento nas concentrações plasmáticas de aminoácidos que não diferem substancialmente da maioria das proteínas ou fontes de proteínas de origem animal (Brennan et al., 2019; Gorissen et al., 2016; Liu et al., 2019; Pinckaers et al., 2021; Tang et al., 2009). É mais que provável que os fatores antinutricionais presentes nos alimentos de origem vegetal não apenas comprometam a biodisponibilidade da proteína, mas também atenuem o aumento pós-prandial nas concentrações plasmáticas dos aminoácidos. Por causa das claras diferenças na absorção e digestão de proteínas e na cinética de absorção de aminoácidos, precisamos de cautela ao nos referirmos às proteínas de origem vegetal, como fontes de proteínas a base de plantas (alimentos), ou proteínas isoladas e concentrados de proteínas derivadas de plantas.
QUALIDADE DAS PROTEÍNAS
O aumento nas concentrações plasmáticas dos aminoácidos após a ingestão de proteínas ativa o mecanismo da síntese proteica no tecido musculoesquelético e também fornece os blocos construtores necessários requisitados para permitir que as taxas de síntese de proteínas musculares aumentem. Os aminoácidos essenciais são considerados os principais responsáveis pela estimulação da síntese de proteínas musculares. Consequentemente, as proteínas com alto, ou maior, conteúdo de aminoácidos serão consideradas proteínas de alta, ou maior qualidade, e mais prováveis de estimular (expressivamente) a síntese de proteínas musculares. O conteúdo de aminoácidos das proteínas de origem vegetal é geralmente menor em comparação com proteínas de origem animal (Gorissen et al., 2018; van Vliet et al., 2015). Contudo, há também proteínas de origem vegetal (como a proteína da soja, do arroz integral, da canola, da ervilha, do milho e proteína da batata) que apresentam um conteúdo de aminoácidos relativamente alto, atingindo as necessidades recomendadas pela WHO/FAO/UNU (FAO/WHO/UNU encontro de especialistas, 2007). Portanto, diversas proteínas de origem vegetal podem fornecer aminoácidos essenciais o suficiente para permitir um expressivo aumento na síntese de proteínas musculares. De todos os aminoácidos, a leucina parece apresentar as propriedades anabólicas mais potentes. O conteúdo de leucina da proteína alimentar é, portanto, considerado outra característica fundamental que determina as propriedades anabólicas da proteína. No momento, o requisito de leucina em uma dada fonte de proteína é estabelecido em 5.9% pela WHO/FAO/UNU (FAO/WHO/UNU encontro de especialistas, 2007). Enquanto as proteínas de origem vegetal como o cânhamo (5,1% de leucina) e o tremoço (5,2%) ficam abaixo do requisito, outras proteínas como a da soja (6,9%), da canola (6,9%), da ervilha (7,2%), do arroz integral (7,4%), da batata (8,3%) e do milho (13,5%) contêm leucina em quantidades superiores aos requisitos recomendados. O teor de leucina da proteína da batata (8,3%) é ainda maior quando comparado com a caseína (8,0%) ou com a proteína do ovo (7,0%). Além disso, o teor de leucina da proteína do milho (13,5%) é mais alto que o do whey (11,0%), com o último sendo relacionado à proteína com o conteúdo mais alto de leucina e com o potencial anabólico mais expressivo entre as proteínas convencionais de origem animal. Além do conteúdo relativamente baixo de aminoácidos essenciais (como, conteúdo baixo de leucina), muitas proteínas de origem vegetal são deficientes em um ou mais aminoácidos específicos. Frequentemente, as proteínas de origem vegetal são particularmente pobres no conteúdo de lisina e/ou metionina (variando de 1,4% a 6,0% e 0,2% a 2,5%, respectivamente) em comparação com proteínas de origem animal (variando de 5,3% a 9,0% e 2,2% a 2,8%, respectivamente). No entanto, há uma considerável variabilidade na composição de aminoácidos entre as muitas fontes vegetais de proteínas e as proteínas derivadas de plantas (Gorissen et al., 2018; van Vliet et al., 2015).
Apenas alguns poucos estudos compararam diretamente as taxas de síntese de proteínas musculares pós-prandial após a ingestão de proteínas de origem vegetal versus de origem animal (Churchward-Venne et al., 2019b; Gorissen et al., 2016; Pinckaers et al., 2021; Tang et al., 2009; Wilkinson et al., 2007; Yang et al., 2012b). A ingestão da proteína da soja mostrou-se menos efetiva na estimulação das taxas de síntese de proteínas musculares em comparação com uma quantidade equivalente de whey no repouso e durante a recuperação do exercício (Tang et al., 2009; Wilkinson et al., 2007; Yang et al., 2012b). Além disso, Yang et al. (2012b) mostrou que ingerir uma maior quantidade (40 g vs. 20 g) de proteína da soja não compensou pela menor resposta na síntese de proteínas musculares em comparação com a ingestão de 20 g de whey, enquanto nenhum aumento significativo na taxa de síntese de proteínas musculares foi observado após a ingestão de 35 g da proteína do trigo em um grupo de homens mais velhos (Gorissen et al., 2016). Contudo, um aumento sólido na taxa de síntese de proteínas musculares foi observado quando a quantidade da proteína do trigo foi elevada para 60 g, fornecendo a quantidade equivalente de leucina fornecida nos 35 g de whey (Gorissen et al., 2016). Estes dados sustentam a hipótese de que as diferenças na composição de aminoácidos podem ser, ao menos em parte, compensadas pela ingestão de maiores quantidades de uma certa proteína, ou fonte da proteína.
APRIMORANDO A FUNCIONALIDADE DA PROTEÍNA
As menores propriedades anabólicas das proteínas de origem vegetal em comparação com as proteínas animais podem ser atribuídas a diferenças na capacidade de absorção e digestão das proteínas e na cinética de absorção dos aminoácidos e/ou na composição de aminoácidos das proteínas. Dependendo do fator, ou fatores responsáveis, há diversas estratégias que podem ser aplicadas para aumentar as propriedades anabólicas das proteínas de origem vegetal. Processar os alimentos pode aumentar expressivamente a capacidade de absorção das próprias proteínas (Devi et al., 2018). A extração da proteína e purificação dos fatores antinutricionais irá melhorar a biodisponibilidade desta proteína (Gausserès et al., 1997). O tratamento térmico e a hidrolisação da proteína pode aumentar ainda mais a digestibilidade e/ou melhorar a digestão da proteína e a cinética de absorção dos aminoácidos (Gorissen et al., 2015; Koopman et al., 2009a). Normalmente, tais processos são aplicados na maioria das fontes vegetais de proteínas, assim como nas fontes animais que compramos, seja como produtos alimentícios (processados) ou proteínas isoladas e concentrados de proteínas.
As menores propriedades anabólicas de algumas proteínas de origem vegetal podem também ser atribuídas ao baixo, ou menor, conteúdo de aminoácidos essenciais e/ou devido às deficiências de aminoácidos específicos. Uma maneira simples de compensar a menor qualidade da proteína de uma fonte vegetal é consumi-la em maior quantidade (Yang et al., 2012a). Apesar de tal estratégia ser de fácil aplicação quando se consome uma proteína isolada ou um concentrado de proteínas de origem vegetal, pode não ser prática, ou viável, no consumo de alimentos de origem vegetal. Devido à baixa densidade da proteína na maioria das fontes vegetais de proteínas, ingerir uma maior quantidade de proteínas poderia se traduzir na prática em um aumento desproporcional no volume de alimentos e no conteúdo de calorias dos alimentos de origem vegetal que precisariam ser consumidos (Figuras 1, 2).

Figura 1. Quantidade de alimentos que precisa ser consumida para permitir a ingestão de 20 g de proteínas. Da menor para a maior: carne, soja, ervilha, grão de bico, arroz integral, e batata, respectivamente.
Tradução da Figura: 20 g de Proteína// Carne 70 g//Soja 90 g//Ervilha 240 g//Grão de bico 260 g//Arroz integral 650 g//Batata 1050 g
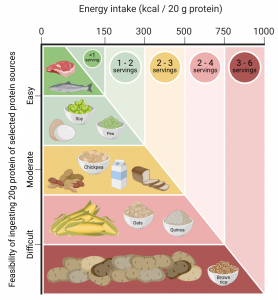
Figura 2: Viabilidade de consumir 20 g de proteína pelo consumo de alimentos (eixo x), expresso pelo número de porções que seriam necessárias (tamanho das porções: carne/salmão: ~100 g, ovo: ~120 g (2 ovos), soja: ~100 g, ervilha: ~150 g, grão de bico: ~150 g, amendoim: ~50 g, pão (trigo): ~70 g (2 fatias), leite: ~200 ml, milho: ~150 g, aveia ~40 g (crua), quinua: ~75 g (crua), arroz integral: ~75 g (cru), batata: 175 g), com a representação da quantidade de energia consumida (eixo y).
Tradução da Figura: Ingestão de energia (kcal/ 20 g de proteínas) // Viabilidade de ingestão de 20 g de proteínas das fontes de proteínas selecionadas // Difícil / Moderado / Fácil // Serving = porção // Soja / Ervilha / Grão de Bico / Aveia / Quinua / Arroz integral
Outra estratégia para aumentar o potencial anabólico de uma fonte de proteína de origem vegetal de baixa qualidade é combinar diferentes proteínas e/ou fontes para fornecer uma mistura de proteínas com um perfil de aminoácidos mais balanceado, sem quaisquer deficiências aparentes. Por exemplo, a proteína do milho, do cânhamo, do arroz integral, da soja e da ervilha tem baixo conteúdo de lisina e/ou metionina (Gorissen et al., 2018). Estas deficiências podem ser compensadas pelo consumo de até 4 vezes mais da mesma proteína. No entanto, quando se combina a proteína do milho, do cânhamo ou do arroz integral (baixo conteúdo de lisina e alto conteúdo de metionina) com uma quantidade igual da proteína da soja ou da ervilha (baixo conteúdo de metionina e alto conteúdo de lisina), se consegue criar uma mistura de proteínas com um perfil de aminoácidos mais balanceado compensando em grande parte qualquer deficiência de aminoácidos (Gorissen et al., 2018). Além das misturas exclusivas de proteínas de origem vegetal, as combinações de proteínas de origem vegetal adicionadas proteínas de origem animal podem também ser de grande valor, como meio de reduzir o consumo de alimentos de origem animal sem comprometer a qualidade da proteína em geral. Como respaldo, aumentos sólidos nas taxas pós-prandiais de síntese de proteínas musculares foram relatados após a ingestão de misturas de proteínas do whey, da caseína e da soja (Reidy et al., 2013). Muitas outras misturas de proteínas podem ser compostas para atingir objetivos específicos em relação à composição dos aminoácidos, ao preço, sabor e à sustentabilidade sem comprometer a capacidade de estímulo da síntese de proteínas musculares (Pinckaers et al., 2021).
Se uma deficiência de aminoácidos específica for o fator limitante para uma proteína de origem vegetal (fonte) em aumentar a síntese de proteínas musculares, uma opção alternativa seria fortificar o produto com o aminoácido (livre), ou aminoácidos (livres) específicos. Como respaldo, a fortificação com leucina de uma dose bolus de proteína intacta, uma mistura de aminoácidos ou uma refeição mista foi relatada aumentar posteriormente as taxas de síntese de proteínas (Katsanos et al., 2006; Rieu et al., 2006; Wall et al., 2013). Até onde sabemos, poucos dados estão disponíveis sobre o impacto da fortificação de leucina nas proteínas de origem vegetal como meio de posteriormente aumentar a síntese de proteínas musculares. Um estudo com roedores demonstrou menores taxas de síntese de proteínas musculares após a ingestão da proteína do trigo versus whey (Norton et al., 2012). A fortificação da proteína do trigo com leucina livre, para igualar o conteúdo de leucina de uma quantidade equivalente de whey, aumentou as taxas de síntese de proteínas musculares a um nível que já não diferia da resposta observada após o consumo de whey. Em contrapartida, não observamos maiores taxas de síntese de proteínas musculares após a ingestão de 20 g da proteína de soja fortificada com 2,5 g de leucina livre, em comparação com apenas 20 g da proteína de soja (Churchward-Venne et al., 2019b). Podemos apenas supor que, nestas condições, o conteúdo de leucina não foi um fator limitante para o aumento pós-prandial nas taxas de síntese de proteínas musculares. Com muitas proteínas de origem vegetal sendo deficientes em lisina e/ou metionina, levantou-se a hipótese de que a fortificação dessas proteínas de origem vegetal seja necessária para estimular por completo seu potencial anabólico. Apesar desta fortificação com aminoácidos livres ser aplicada comumente em produtos de origem vegetal desenvolvidos para substituir os produtos derivados da carne ou do leite, não há estudos que avaliaram a eficácia da fortificação com aminoácidos livres para aumentar (mais) as taxas de síntese de proteínas musculares após o consumo de tais proteínas de origem vegetal.
PROCESSAMENTO DAS PROTEÍNAS APÓS A INGESTÃO DE REFEIÇÕES
Trabalhos sobre as propriedades anabólicas das proteínas de origem vegetal foram em grande parte limitados a um grupo de proteínas isoladas ou concentrados de proteínas derivadas de plantas e animais. Contudo, as proteínas alimentares são geralmente consumidas na forma de alimentos ou produtos alimentícios, e como parte de uma refeição mista, mais completa. Quando se consome proteínas como parte de um produto e/ou refeição, outros nutrientes como os carboidratos, gorduras, micronutrientes e outros compostos nutricionais (e antinutricionais) podem modificar a digestão pós-prandial das proteínas, a cinética de absorção dos aminoácidos e as taxas de síntese de proteínas musculares subsequentes (Trommelen et al., 2019). Como respaldo, nós (Gorissen et al., 2014; Koopman et al., 2007) mostramos que a digestão pós-prandial das proteínas e a absorção dos aminoácidos podem ser retardadas quando carboidratos ou gorduras, são ingeridos em conjunto com as proteínas. No entanto, a ingestão em conjunto de carboidratos e proteínas não parece modular as taxas de síntese de proteínas musculares durante a recuperação do exercício (Koopman et al., 2007).
Embora tais estudos forneçam um insight do impacto da ingestão conjunta com outros macronutrientes na digestão de proteínas e na cinética de absorção de aminoácidos e no posterior estímulo pós-prandial da síntese de proteínas musculares, eles não refletem necessariamente a resposta anabólica à ingestão de alimentos das quais as proteínas são derivadas. Considerando que diversos estudos avaliaram as taxas da síntese de proteínas musculares após a ingestão de alimentos como o leite (Burd et al., 2015), a carne (Burd et al., 2015; Robinson et al., 2013) e ovos (van Vliet et al., 2017), quase não há trabalhos realizados sobre as respostas anabólicas na ingestão de alimentos à base de plantas ou refeições mistas. Isto nos impede de compreender as verdadeiras propriedades anabólicas do consumo de alimentos de origem vegetal, já que a matriz alimentar destes alimentos derivados de plantas pode comprometer a digestão de proteínas e a cinética de absorção de aminoácidos, e atenuar o aumento pós-prandial das taxas de síntese de proteínas musculares. A resposta da síntese de proteínas musculares à ingestão de refeições é complexa e não pode ser simplesmente prevista pela composição de aminoácidos das proteínas ou pelas concentrações plasmáticas de aminoácidos na circulação.
PROTEÍNAS DERIVADAS DE PLANTAS NA NUTRIÇÃO ESPORTIVA
A transição para uma dieta mais baseada em vegetais também ganhou interesse entre atletas e treinadores. Não surpreendentemente, isto levantou muitas questões em relação ao impacto de consumir proteínas de origem vegetal de (menor) qualidade na recuperação e no condicionamento muscular após o exercício. Há alguns estudos que compararam as respostas da síntese de proteínas musculares no pós-exercício após a ingestão de proteínas de origem vegetal versus animal (Churchward-Venne et al., 2019b; Gorissen et al., 2016; Pinckaers et al., 2021; Tang et al., 2009; Wilkinson et al., 2007; Yang et al., 2012b). Nestes estudos, a principal proteína de origem vegetal empregada é a proteína de soja. Alguns (Tang et al., 2009; Wilkinson et al., 2007; Yang et al., 2012b), mas certamente não todos (Churchward-Venne et al., 2019b) os estudos relataram um menor aumento na síntese de proteínas musculares no pós-exercício após a ingestão da proteína da soja em comparação com uma quantidade equivalente da proteína do leite ou whey. O exercício torna a musculatura mais sensível às propriedades anabólicas da administração de aminoácidos ou proteínas. Portanto, poderia se especular que o aumento pós-prandial nas concentrações de leucina circulante é de menor importância quando a proteína é consumida durante a recuperação do exercício. O baixo (ou menor) conteúdo de leucina da maioria das proteínas de origem vegetal pode não comprometer as taxas de síntese de proteínas musculares durante os estágios agudos da recuperação do exercício. A capacidade da proteína em sustentar o aumento pós-exercício na síntese de proteínas musculares provavelmente será mais determinada pela quantidade de aminoácidos e pela taxa em que eles são fornecidos como precursores para a síntese de proteínas musculares. Uma grande provisão de todos os aminoácidos sem quaisquer deficiências de aminoácidos específicos pode ser de importância primordial quando se determina a proteína (ou mistura de proteínas) de origem vegetal ideal para auxiliar o condicionamento muscular no período pós-exercício.
Estudos de intervenção de longo-prazo tendem a mostrar maiores ganhos de massa muscular e de força quando a suplementação de proteínas é empregada durante os treinos prolongados com exercícios de musculação de resistência (Cermak et al., 2012). Aumentos nas taxas diárias da síntese de proteínas musculares e/ou ganhos de massa muscular foram relatados após treinos com exercícios de musculação de resistência na suplementação com proteínas de origem vegetal como a proteína da soja, da ervilha, do arroz e da batata (Lim et al., 2021). É improvável que estes ganhos de massa muscular e de força teriam diferido muito dos ganhos observados na suplementação com uma quantidade equivalente de proteínas de origem animal. Uma recente meta-análise concluiu que a origem animal versus vegetal da fonte da proteína suplementada não afeta significativamente os ganhos de massa magra ou de força muscular após treinos com exercícios de resistência (Lim et al., 2021). Além disso, um trabalho recente (Hevia-Larraín et al., 2021) não relatou diferenças nos ganhos de massa muscular e de força após treino prolongado com exercícios de resistência com o consumo de dieta exclusiva à base de plantas ou uma dieta onívora. Isto não deve ser uma surpresa, pois os indivíduos não treinados participando do estudo estavam consumindo uma dieta com alta ingestão de proteínas (~ 1,6 g de proteína/kg de massa corporal/dia), com quantidades significativas de proteínas isoladas da soja, ou whey, sendo suplementados duas vezes ao dia.
Com base nas diferenças descritas na capacidade de absorção de proteínas, na digestão de proteínas e na cinética dos aminoácidos, e na composição de aminoácidos entre as fontes de proteínas de origem vegetal e animal, parece justo assumir que a transição para uma dieta mais baseada em plantas necessitaria do consumo de uma maior quantidade de proteínas. No entanto, a maioria dos atletas já consome grandes quantidades de proteína devido à alta ingestão de energia. Uma pesquisa nacional com atletas com bom condicionamento físico relatou uma ingestão de proteínas de 1,5 g de proteína/kg de massa corporal/dia (Gillen et al., 2017). Apesar disso representar uma ingestão diária de proteínas bem acima da Ingestão Dietética Recomendada (Recommended Daily Allowance (RDA)), tem sido discutido que a ingestão de proteínas de até 1,6 g/kg de massa corporal/dia iria maximizar os ganhos de massa muscular e de força durante treinos prolongados com exercícios de resistência. Consequentemente, poderia se especular que uma dieta fornecendo proteínas de baixa (ou menor) qualidade poderia comprometer a resposta adaptativa da musculatura esquelética aos treinos. Contudo, esta última especulação representa mais um conceito acadêmico, já que pequenas diferenças na qualidade da proteína não irão gerar muito impacto na resposta adaptativa aos treinos quando estas grandes quantidades de proteína são habitualmente consumidas. Além disso, deve-se notar que os atletas já obtêm mais de 40% da sua ingestão diária habitual de proteínas de fontes de origem vegetal (Gillen et al., 2017). Mais importante é o possível impacto negativo da transição para uma dieta mais baseada em plantas em um ambiente onde atletas reduzem sua ingestão de energia, e desta forma, reduzem como consequência o consumo de proteínas. Atletas que estão tentando reduzir o peso corporal pela restrição calórica, ou atletas que se recuperam de uma lesão, na verdade, necessitariam de uma ingestão de proteínas (absoluta) similar, ou mesmo maior, enquanto consomem menor quantidade de alimentos. Em tais condições, a densidade das proteínas dos alimentos e a qualidade da proteína consumida se torna fundamental. A transição para uma dieta com menores propriedades anabólicas poderia comprometer a manutenção muscular e atenuar o novo ganho de músculos. Claramente, precisamos avaliar os aspectos positivos, assim como os possíveis aspectos negativos da transição para uma dieta mais baseada em vegetais. Embora existam muitos benefícios para a saúde esperados da transição para uma dieta mais exclusivamente à base de plantas, precisamos avaliar se ela é acompanhada de uma mudança para uma maior necessidade de proteínas alimentares em ambos os casos de saúde e de doença.
OUTRAS FONTES DE PROTEÍNA
Atualmente, investimentos imensos estão acontecendo na busca de uma produção mais sustentável de fontes de proteínas de alta qualidade que não são derivadas de animais. Este processo foi agora expandido das fontes de proteínas de origem vegetal para diversas outras possíveis fontes de proteínas adequadas para o consumo humano. Tais fontes de proteínas incluem leveduras, fungos, microalgas, insetos e até mesmo carnes produzidas em laboratório. Pesquisas estão em andamento para estabelecer a biodisponibilidade e a funcionalidade de muitas destas novas fontes de proteínas. É provável que muitas destas fontes alternativas irão rapidamente encontrar um lugar nos produtos desenvolvidos para a nutrição esportiva.
RESUMO
Atualmente, há um crescente interesse na transição para o consumo de uma dieta mais baseada em vegetais. Consumir uma dieta à base de plantas irá aumentar a ingestão de proteínas de origem vegetal ao invés das proteínas de origem animal. Até o momento, pesquisas mostraram que a ingestão de proteínas de origem vegetal, como a proteína da soja e do trigo, não estimula a síntese de proteínas musculares na mesma proporção que uma quantidade equivalente de proteínas de origem animal. As menores propriedades anabólicas das proteínas de origem vegetal em comparação com as proteínas de origem animal foram atribuídas a diferenças na digestão das proteínas e na cinética de absorção dos aminoácidos, assim como na composição de aminoácidos destas proteínas. A maioria das proteínas de origem vegetal apresenta menor conteúdo de aminoácidos essenciais em comparação com as proteínas de origem animal, e podem ser deficientes em um ou mais aminoácidos específicos. Poucos estudos compararam diretamente as taxas de síntese de proteínas musculares após a ingestão de proteínas de origem vegetal versus proteínas de origem animal de alta (ou mais alta) qualidade. As menores propriedades anabólicas das proteínas de origem vegetal versus de origem animal podem ser compensadas pelo: consumo de maior quantidade de proteínas de origem vegetal (fontes), utilização de misturas de diferentes proteínas de origem vegetal para criar um perfil de aminoácidos mais balanceado, e/ou pela fortificação das fontes de proteínas de origem vegetal com os aminoácidos (livres) específicos deficientes. Mais trabalhos são necessários para avaliar as propriedades anabólicas das diferentes proteínas e suas fontes e para identificar os fatores que podem, ou não, comprometer a capacidade de estimulação da síntese de proteínas musculares. Como os atletas ativos e saudáveis normalmente consomem uma dieta que fornece bem acima da quantidade de ~1,5 g de proteínas/dia, uma proteína de menor qualidade provavelmente não irá comprometer o condicionamento muscular em atletas que adotam uma dieta (mais) à base de plantas. Contudo, quando os atletas estão em transição para uma dieta à base de plantas em condições de baixa ingestão de energia e/ou de proteínas, consultar um nutricionista esportivo é recomendado para garantir uma provisão suficiente de proteínas.
Os pontos de vistas expressos neste artigo são dos autores e não refletem necessariamente a posição ou políticas da PepsiCo, Inc.
REFERÊNCIAS
Boirie, Y., M. Dangin, P. Gachon, M.-P. Vasson, J.-L. Maubois, and B. Beaufrère (1997). Slow and fast dietary proteins differently modulate postprandial protein accretion. Proc. Nat. Acad. Sci. 94:14930-14935.
Brennan, J.L., M. Keerati-U-Rai, H. Yin, J. Daoust, E. Nonnotte, L. Quinquis, T. St-Denis, and D.R. Bolster (2019). Differential responses of blood essential amino acid levels following ingestion of high-quality plant-based protein blends compared to whey protein—a double-blind randomized, cross-over, clinical trial. Nutrients 11:2987.
Burd, N.A., S.H. Gorissen, S. van Vliet, T. Snijders, and L.J. van Loon (2015). Differences in postprandial protein handling after beef compared with milk ingestion during postexercise recovery: a randomized controlled trial. Am. J. Clin. Nutr. 102:828-836.
Cermak, N.M., P.T. Res, L.C. de Groot, W.H. Saris, and L.J. van Loon (2012). Protein supplementation augments the adaptive response of skeletal muscle to resistance-type exercise training: a meta-analysis. Am. J. Clin. Nutr. 96:1454-1464.
Churchward-Venne, T.A., P.J.M. Pinckaers, J.S.J. Smeets, W.M. Peeters, A.H. Zorenc, H. Schierbeek, I. Rollo, L.B. Verdijk, and L.J.C. van Loon (2019a). Myofibrillar and mitochondrial protein synthesis rates do not differ in young men following the ingestion of carbohydrate with milk protein, whey, or micellar casein after concurrent resistance- and endurance-type exercise. J. Nutr. 149:198-209.
Churchward-Venne, T.A., P.J.M. Pinckaers, J.S.J. Smeets, W.M. Peeters, A.H. Zorenc, H. Schierbeek, I. Rollo, L.B. Verdijk, and L.J.C. van Loon (2019b). Myofibrillar and mitochondrial protein synthesis rates do not differ in young men following the ingestion of carbohydrate with whey, soy, or leucine-enriched soy protein after concurrent resistance- and endurance-type exercise. J. Nutr. 149:210-220.
Churchward-Venne, T.A., P.J.M. Pinckaers, J.S.J. Smeets, M.W. Betz, J.M. Senden, J.P.B. Goessens, A.P. Gijsen, I. Rollo, L.B. Verdijk, and L.J.C. van Loon (2020). Dose-response effects of dietary protein on muscle protein synthesis during recovery from endurance exercise in young men: a double-blind randomized trial. Am. J. Clin. Nutr. 112:303-317.
Devi, S., A. Varkey, M.S. Sheshshayee, T. Preston, and A.V. Kurpad (2018). Measurement of protein digestibility in humans by a dual-tracer method. Am. J. Clin Nutr. 107:984-991.
Dickinson, J.M., D.M. Gundermann, D.K. Walker, P.T. Reidy, M.S. Borack, M.J. Drummond, M. Arora, E. Volpi, and R.B. Rasmussen (2014). Leucine-enriched amino acid ingestion after resistance exercise prolongs myofibrillar protein synthesis and amino acid transporter expression in older men. J. Nutr. 144:1694-1702.
FAO/WHO/UNU expert consultation (2007). Protein and amino acid requirements in human nutrition. WHO Technical Report Series 935:1-265.
Gausserès, N., S. Mahé, R. Benamouzig, C. Luengo, F. Ferriere, J. Rautureau, and D. Tomé (1997). [15N]-labeled pea flour protein nitrogen exhibits good ileal digestibility and postprandial retention in humans. J. Nutr. 127:1160-1165.
Gillen, J.B., J. Trommelen, F.C. Wardenaar, N.Y.J. Brinkmans, J.J. Versteegen, K.L. Jonvik, C. Kapp, J. De Vries, J.J.G.C. Van Den Borne, M.J. Gibala, and L.J.C. Van Loon (2017). Dietary protein intake and distribution patterns of well-trained dutch athletes. Int. J. Sport Nutr. Exerc. Metab. 27:105-114.
Gorissen, S.H., N.A. Burd, H.M. Hamer, A.P. Gijsen, B.B. Groen, and L.J. van Loon (2014). Carbohydrate coingestion delays dietary protein digestion and absorption but does not modulate postprandial muscle protein accretion. J. Clin. Endocrinol. Metab. 99:2250-2258.
Gorissen, S.H., D. Remond, and L.J. van Loon (2015). The muscle protein synthetic response to food ingestion. Meat Sci. 109:96-100.
Gorissen, S.H., A.M. Horstman, R. Franssen, J.J. Crombag, H. Langer, J. Bierau, F. Respondek, and L.J. van Loon (2016). Ingestion of wheat protein increases in vivo muscle protein synthesis rates in healthy older men in a randomized trial. J. Nutr. 146:1651-1659.
Gorissen, S.H., J.J. Crombag, J.M. Senden, W.H. Waterval, J. Bierau, L.B. Verdijk, and L.J. van Loon (2018). Protein content and amino acid composition of commercially available plant-based protein isolates. Amino Acids 50:1685-1695.
Gorissen, S.H.M., J. Trommelen, I.W.K. Kouw, A.M. Holwerda, B. Pennings, B.B.L. Groen, B.T. Wall, T.A. Churchward-Venne, A.M.H. Horstman, R. Koopman, N.A. Burd, C.J. Fuchs, M.L. Dirks, P.T. Res, J.M.G. Senden, J.M.J.M. Steijns, L.C.P.G.M. De Groote, L.B. Verdijk, and L.J.C. van Loon (2020). Protein type, protein dose, and age modulate dietary protein digestion and phenylalanine absorption kinetics and plasma phenylalanine availability in humans. J. Nutr. 150:2041-2050.
Groen, B.B., A.M. Horstman, H.M. Hamer, M. de Haan, J. van Kranenburg, J. Bierau, M. Poeze, W.K. Wodzig, B.B. Rasmussen, and L.J. van Loon (2015). Post-prandial protein handling: you are what you just ate. PloS One 10:e0141582.
Hevia-Larraín, V., B. Gualano, I. Longobardi, S. Gil, A.L. Fernandes, L.A.R. Costa, R.M.R. Pereira, G.G. Artioli, S.M. Phillips, and H. Roschel (2021). High-protein plant-based diet versus a protein-matched omnivorous diet to support resistance training adaptations: A comparison between habitual vegans and omnivores. Sports Med. 51:1317-1330.
Kashyap, S., N. Shivakumar, A. Varkey, R. Duraisamy, T. Thomas, T. Preston, S. Devi, and A.V. Kurpad (2018). Ileal digestibility of intrinsically labeled hen’s egg and meat protein determined with the dual stable isotope tracer method in Indian adults. Am. J. Clin. Nutr. 108:980-987.
Kashyap, S., A. Varkey, N. Shivakumar, S. Devi, B.H.R. Reddy, T. Thomas, T. Preston, S. Sreeman, and A.V. Kurpad (2019). True ileal digestibility of legumes determined by dual-isotope tracer method in Indian adults. Am. J. Clin. Nutr. 110:873-882.
Katsanos, C.S., H. Kobayashi, M. Sheffield-Moore, A. Aarsland, and R.R. Wolfe (2006). A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. Am. J. Physiol. 291:E381-E387.
Koopman, R., A.J.M. Wagenmakers, R.J.F. Manders, A.H.G. Zorenc, J.M.G. Senden, M.Gorselink, H.A. Keizer, and L.J.C. Van Loon (2005). Combined ingestion of protein and free leucine with carbohydrate increases postexercise muscle protein synthesis in vivo in male subjects. Am. J. Physiol. 288:E645-E653.
Koopman, R., M. Beelen, T. Stellingwerff, B. Pennings, W.H.M. Saris, A.K. Kies, H. Kuipers, and L.J.C. Van Loon (2007). Coingestion of carbohydrate with protein does not further augment postexercise muscle protein synthesis. Am. J. Physiol. 293:E833-E842.
Koopman, R., N. Crombach, A.P. Gijsen, S. Walrand, J. Fauquant, A.K. Kies, S. Lemosquet, W.H. Saris, Y. Boirie, and L.J. van Loon (2009a). Ingestion of a protein hydrolysate is accompanied by an accelerated in vivo digestion and absorption rate when compared with its intact protein. Am. J. Clin. Nutr. 90:106-115.
Koopman, R., S. Walrand, M. Beelen, A.P. Gijsen, A.K. Kies, Y. Boirie, W.H. Saris, and L.J. van Loon (2009b). Dietary protein digestion and absorption rates and the subsequent postprandial muscle protein synthetic response do not differ between young and elderly men. J. Nutr. 139:1707-1713.
Lim, M.T., B.J. Pan, D.W.K. Toh, C.N. Sutanto, and J.E. Kim (2021). Animal protein versus plant protein in supporting lean mass and muscle strength: a systematic review and meta-analysis of randomized controlled trials. Nutrients 13:661.
Liu, J., M. Klebach, M. Visser, and Z. Hofman (2019). Amino acid availability of a dairy and vegetable protein blend compared to single casein, whey, soy, and pea proteins: a double-blind, cross-over trial. Nutrients 11:2613.
Moore, D.R., M.J. Robinson, J.L. Fry, J.E. Tang, E.I. Glover, S.B. Wilkinson, T. Prior, M.A. Tarnopolsky, and S.M. Phillips (2009a). Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am. J. Clin. Nutr. 89:161-168.
Moore, D.R., J.E. Tang, N.A. Burd, T. Rerecich, M.A. Tarnopolsky, and S.M. Phillips (2009b). Differential stimulation of myofibrillar and sarcoplasmic protein synthesis with protein ingestion at rest and after resistance exercise. J. Physiol. 587:897-904.
Norton, L.E., G.J. Wilson, D.K. Layman, C.J. Moulton, and P.J. Garlick (2012). Leucine content of dietary proteins is a determinant of postprandial skeletal muscle protein synthesis in adult rats. Nutr. Metab. 9:67.
Pennings, B., Y. Boirie, J.M. Senden, A.P. Gijsen, H. Kuipers, and L.J. van Loon (2011). Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am. J. Clin. Nutr. 93:997-1005.
Pinckaers, P.J.M., I.W.K. Kouw, F.K. Hendriks, J.M.X. Van Kranenburg, L.C.P.G.M. De Groot, L.B. Verdijk, T. Snijders, and L.J.C. Van Loon (2021). No differences in muscle protein synthesis rates following ingestion of wheat protein, milk protein, and their protein blend in healthy, young males. Br, J. Nutr. 18:1-11.
Reidy, P.T., D.K. Walker, J.M. Dickinson, D.M. Gundermann, M.J. Drummond, K.L. Timmerman, C.S. Fry, M.S. Borack, M.B. Cope, R. Mukherjea, K. Jennings, E. Volpi, and B.B. Rasmussen (2013). Protein blend ingestion following resistance exercise promotes human muscle protein synthesis. J. Nutr. 143:410-416.
Rieu, I., M. Balage, C. Sornet, C. Giraudet, E. Pujos, J. Grizard, L. Mosoni, and D. Dardevet (2006). Leucine supplementation improves muscle protein synthesis in elderly men independently of hyperaminoacidaemia. J. Physiol. 575:305-315.
Robinson, M.J., N.A. Burd, L. Breen, T. Rerecich, Y. Yang, A.J. Hector, S.K. Baker, and S.M. Phillips (2013). Dose-dependent responses of myofibrillar protein synthesis with beef ingestion are enhanced with resistance exercise in middle-aged men. Appl. Physiol. Nutr. Metab. 38:120-125.
Sarwar Gilani, G., C. Wu Xiao, and K.A. Cockell (2012). Impact of antinutritional factors in food proteins on the digestibility of protein and the bioavailability of amino acids and on protein quality. Br. J. Nutr. 108:S315-S332.
Tang, J.E., J.J. Manolakos, G.W. Kujbida, P.J. Lysecki, D.R. Moore, and S.M. Phillips (2007). Minimal whey protein with carbohydrate stimulates muscle protein synthesis following resistance exercise in trained young men. Appl. Physiol. Nutr. Metab. 32:1132-1138.
Tang, J.E., D.R. Moore, G.W. Kujbida, M.A. Tarnopolsky, and S.M. Phillips (2009). Ingestion of whey hydrolysate, casein, or soy protein isolate: effects on mixed muscle protein synthesis at rest and following resistance exercise in young men. J. Appl. Physiol. 107:987-992.
Tipton, K.D., T.A. Elliott, M.G. Cree, S.E. Wolf, A.P. Sanford, and R.R. Wolfe (2004). Ingestion of casein and whey proteins result in muscle anabolism after resistance exercise. Med. Sci. Sports Exerc. 36:2073-2081.
Trommelen, J., M.W. Betz, and L.J.C. Van Loon (2019). The muscle protein synthetic response to meal ingestion following resistance-type exercise. Sports Med. 49:185-197.
Trommelen, J., A.M. Holwerda, P.J.M. Pinckaers, and L.J.C. Van Loon (2021a). Comprehensive assessment of post-prandial protein handling by the application of intrinsically labelled protein in vivo in human subjects. Proc. Nutr. Soc. 80:221-229.
Trommelen, J., D. Tomé, and L.J.C. Van Loon (2021b). Gut amino acid absorption in humans: concepts and relevance for postprandial metabolism. Clin. Nutr. 36:43-55.
van Vliet, S., N.A. Burd, and L.J. van Loon (2015). The skeletal muscle anabolic response to plant- versus animal-based protein consumption. J. Nutr. 145:1981-1991.
van Vliet, S., E.I. Shy, S. Abou Sawan, J.W. Beals, D.W. West, S.K. Skinner, A.V. Ulanov, Z. Li, S.A. Paluska, C.M. Parsons, D.R. Moore, and N.A. Burd (2017). Consumption of whole eggs promotes greater stimulation of postexercise muscle protein synthesis than consumption of isonitrogenous amounts of egg whites in young men. Am. J. Clin. Nutr. 106:1401-1412.
Wall, B.T., H.M. Hamer, A. de Lange, A. Kiskini, B.B. Groen, J.M. Senden, A.P. Gijsen, L.B. Verdijk, and L.J. van Loon (2013). Leucine co-ingestion improves post-prandial muscle protein accretion in elderly men. Clin. Nutr. 32:412-419.
Wilkinson, S.B., M.A. Tarnopolsky, M.J. Macdonald, J.R. Macdonald, D. Armstrong, and S.M. Phillips (2007). Consumption of fluid skim milk promotes greater muscle protein accretion after resistance exercise than does consumption of an isonitrogenous and isoenergetic soy-protein beverage. Am. J. Clin. Nutr. 85:1031-1040.
Wilkinson, D.J., T. Hossain, D.S. Hill, B.E. Phillips, H. Crossland, J. Williams, P. Loughna, T.A. Churchward-Venne, L. Breen, S.M. Phillips, T. Etheridge, J.A. Rathmacher, K. Smith, N.J. Szewczyk, and P.J. Atherton (2013). Effects of leucine and its metabolite beta-hydroxy-beta-methylbutyrate on human skeletal muscle protein metabolism. J. Physiol. 591:2911-2923.
Wilkinson, D.J., S.S.I. Bukhari, B.E. Phillips, M.C. Limb, J. Cegielski, M.S. Brook, D. Rankin, W.K. Mitchell, H. Kobayashi, J.P. Williams, J. Lund, P.L. Greenhaff, K. Smith, and P.J. Atherton (2018). Effects of leucine-enriched essential amino acid and whey protein bolus dosing upon skeletal muscle protein synthesis at rest and after exercise in older women. Clin. Nutr. 37:2011-2021.
Witard, O.C., S.R. Jackman, L. Breen, K. Smith, A. Selby, and K.D. Tipton (2014). Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise. Am. J. Clin. Nutr. 99:86-95.
Yang, Y., L. Breen, N.A. Burd, A.J. Hector, T.A. Churchward-Venne, A.R. Josse, M.A. Tarnopolsky, and S.M. Phillips (2012a). Resistance exercise enhances myofibrillar protein synthesis with graded intakes of whey protein in older men. Br. J. Nutr. 108:1780-1788.
Yang, Y., T.A. Churchward-Venne, N.A. Burd, L. Breen, M.A. Tarnopolsky, and S.M. Phillips (2012b). Myofibrillar protein synthesis following ingestion of soy protein isolate at rest and after resistance exercise in elderly men. Nutr. Metab. 9:57.






