SSE #221: ÓLEO DE PEIXE PARA O ENVELHECIMENTO SAUDÁVEL: POTENCIAIS APLICAÇÕES PARA ATLETAS MASTER
PONTOS-CHAVE:
- Após aproximadamente 50 anos de idade, as pessoas começam a perder massa muscular e força, um processo atenuado pela prática de exercícios. Adultos mais velhos que praticam atividade física regularmente são chamados de atletas master e frequentemente exibem características fenotípicas semelhantes aos indivíduos mais jovens sedentários.
- Um aspecto essencial que sustenta a resposta adaptativa da musculatura esquelética aos exercícios é a nutrição adequada, com a maioria das pesquisas na área das ciências do esporte e do exercício tendo foco no papel da ingestão de proteínas e carboidratos. Contudo, pesquisas recentes em contextos clínicos com adultos mais velhos indicam um potencial ergogênico dos ácidos graxos poli-insaturados n-3 de cadeia longa (LC n-3 PUFAs).
- Em adultos mais velhos sedentários, a ingestão de LC n-3 PUFAs (~3-5 g/dia) com infusão de aminoácidos e insulina melhora as taxas de síntese de proteínas musculares, promove ganho de tamanho da musculatura e potencializa os ganhos de força com o treinamento de exercício de resistência. Entretanto, nem todos os estudos mostraram um efeito positivo e, portanto, não está claro se a ingestão de LC n-3 PUFAs é ergogênica para atletas master.
- Não há evidências de que o consumo de LC n-3 PUFAs é ergogênico para a performance em exercício de endurance ou recuperação em seres humanos de qualquer idade e com qualquer nível e tipo de treino.
- As recomendações de ingestão atuais para a população são de 250-500 mg de ácido eicosapentaenoico (EPA) + ácido docosa-hexaenoico (DHA) por dia. Há novas evidências de que a ingestão de EPA + DHA acima das quantidades recomendadas melhoram o nível de LC n-3 PUFAs e pode conferir benefícios à saúde em adultos mais velhos; contudo, há a necessidade de pesquisas adicionais.
- Peixes gordurosos são uma fonte excelente de LC n-3 PUFAs e a suplementação é uma opção viável para indivíduos que não podem ou não querem consumir esse tipo de peixe.
INTRODUÇÃO
Após aproximadamente os 50 anos de idade, as pessoas começam a perder massa e força muscular o que pode levar a uma doença conhecida como sarcopenia. A sarcopenia resulta em capacidade reduzida de realizar força e é o principal fator de risco no desenvolvimento de diversos efeitos negativos para a saúde (Janssen, 2006). Acredita-se que a prática de níveis elevados de atividade física e/ou treinamento físico pode atenuar algumas das consequências negativas da sarcopenia (McKendry et al., 2020). Neste sentido, há evidências de que adultos mais velhos que se dedicam regularmente à prática de exercícios – ou os atletas master – apresentem características bioquímicas da musculatura esquelética e de performance semelhantes às de pessoas saudáveis mais jovens (McKendry et al., 2018). Estes achados não apenas destacam a importância da prática de exercícios para promover a performance atlética em atletas master, mas também estimulam o envelhecimento saudável na população em geral.
Um fator essencial no auxílio da performance e na recuperação do exercício é a ingestão nutricional adequada. Por exemplo, a ingestão de carboidratos é indispensável para fornecer energia suficiente para sustentar as necessidades de energia durante o exercício e restaurar os níveis de glicogênio muscular durante o período de recuperação (Burke et al., 2011). A ingestão de proteínas, particularmente proteínas de alta qualidade ricas em aminoácidos, é essencial para a remodelação, reparo e crescimento do tecido muscular esquelético danificado (McGlory et al., 2018). No entanto, o papel dos ácidos graxos para o auxílio nas respostas adaptativas à prática de exercícios não recebeu a mesma atenção. Tradicionalmente associados com a melhor saúde cardiovascular, existem agora novas evidências provenientes do contexto clínico de que a ingestão de ácidos graxos poli-insaturados de cadeia longa n-3 (LC n-3 PUFAs) potencializam o anabolismo da musculatura esquelética em adultos mais velhos (Smith et al., 2015). Estes achados são complementados por trabalhos com pessoas mais jovens indicando um possível papel para os LC n-3 PUFAs na atenuação dos índices de dor muscular e inflamação, e na resposta ao dano gerado pelo exercício (Anthony et al., 2021). Neste artigo do Sports Science Exchange (SSE), iremos desenvolver este tópico a partir de artigos anteriores do SSE, focados principalmente em pessoas mais jovens (Rockwell & Ritz 2021; Witard & Davis 2021) para explorar o potencial dos LC n-3 PUFAs em melhorar a performance e a recuperação do exercício em atletas master. Iremos fornecer também recomendações para a aplicação prática.
O QUE SÃO OS LC N-3 PUFAS?
Os LC n-3 PUFAs são uma classe de ácidos graxos biologicamente ativos, às vezes denominados ácidos graxos ômega-3, consistindo em uma cadeia hidrocarbonada com um grupo ácido carboxílico em uma ponta e um grupo metil (ômega) na outra. A nomenclatura n-3 se refere à posição da primeira dupla ligação de carbono afastada da ponta que apresenta o grupo metil. Os LC n-3 PUFAs mais estudados são o ácido eicosapentaenoico (EPA; 20:5 n-3) e o ácido docosa-hexaenoico (DHA; 22:6 n-3) (Figura 1). As recomendações de ingestão da população para os LC n-3 PUFAs (250-500 mg EPA +DHA/dia) podem ser atingidas com o consumo de 1 a 2 porções (100-140 g/porção) de peixes gordurosos por semana (EFSA, 2005; The Scientific Advisory Committee on Nutrition, 2004; US Department of Health and Human Services and US Department of Agriculture, 2015). Estes ácidos graxos possuem diversos papéis na função celular, como servir de substrato para a produção de mediadores de resolução anti-inflamatórios, assim como inibir a expressão de moléculas pró-inflamatórias. Os LC n-3 PUFAs também são componentes essenciais dos fosfolipídios que compõem nossas membranas (McGlory et al., 2019). Devido ao importante papel dos LC n-3 PUFAs para a saúde e função celular, seu impacto na musculatura esquelética em resposta à prática de exercícios se tornou um tópico cada vez mais presente em pesquisas científicas.
OS LC N-3 PUFAS SÃO ERGOGÊNICOS PARA OS ATLETAS MASTER?
ANABOLISMO DA MUSCULATURA ESQUELÉTICA
Evidências iniciais de que os LC n-3 PUFAs alteram o anabolismo da musculatura esquelética surgiram de trabalhos com bois. Os autores demonstraram que em resposta a uma infusão de óleo de peixe rica em LC n-3 PUFAs, houve um aumento na composição de EPA e DHA das membranas fosfolipídicas da musculatura esquelética e uma disposição duas vezes maior de aminoácidos no organismo inteiro, um indicativo de acréscimo de proteínas (Gingras et al., 2007). Mais tarde, Smith et al. (2011) relatou que as taxas de síntese de proteínas musculares (SPM) foram potencializadas em resposta a um clamp hiperinsulinêmico e alta carga de aminoácidos, após 8 semanas de suplementação com 1,66 g/dia de EPA e 1,50 g/dia de DHA em mulheres e homens mais velhos. Os achados destas taxas potencializadas de SPM em resposta à provisão de aminoácidos e insulina após a ingestão LC n-3 PUFAs é especialmente intrigante devido, apesar dos altos volumes de treino, aos atletas master ainda apresentarem declínios relacionados à idade nas taxas de SPM, semelhantes àqueles de seus pares sedentários (McKendry et al., 2019). Estudos adicionais também relataram melhora no tamanho dos músculos e na força muscular com 6 meses de suplementação de 1,66 g/dia de EPA e 1,50 g/dia de DHA em pessoas mais velhas (Smith et al., 2015), assim como melhor força muscular com a ingestão de LC n-3 PUFAs em resposta às 18 semanas de treinos com exercícios de resistência em mulheres mais velhas (Da Boit et al., 2017) (veja Witard & Davis 2021 para reflexão adicional).
Enquanto há evidências crescentes de que a ingestão de LC n-3 PUFAs possa exercer um impacto positivo em relação à musculatura esquelética, nem todos os estudos mostraram tal efeito. De fato, um estudo recente de Murphy et al. (2021) não observou efeitos benéficos após 6 meses de suplementação com 1,6 g/dia de EPA + 2,3 g/dia de DHA, fornecidos como parte de uma bebida com um mix de macronutrientes contendo proteínas enriquecidas com leucina, na massa muscular apendicular, na força ou na performance física em adultos mais velhos que tiveram baixa massa muscular basal. Além disso, um grande ensaio clínico com mais de 2.000 adultos mais velhos não relatou impacto após 3 anos de suplementação com 0,3 g/dia de EPA + 0,7 g/dia de DHA isoladamente, ou em combinação com treinos de força realizados em casa nos scores de uma bateria de testes para avaliação da capacidade funcional (SPPB – Short Physical Performance Battery) (Bischoff-Ferrari et al., 2020). Apesar disso, mesmo se um efeito da suplementação estivesse presente, teria sido difícil observá-lo no último estudo devido à maioria dos participantes já apresentarem scores iniciais perto dos scores SPPB máximos. Diversos outros fatores foram supostos para explicar a inconsistência entre os estudos em termos do impacto da suplementação com LC n-3 PUFAs nos resultados da musculatura esquelética (como por exemplo, diferenças entre os sexos, ingestão habitual de proteínas, estado de saúde basal, diferenças nas medidas dos resultados), e mais pesquisas são necessárias para testar sistematicamente estas hipóteses. Portanto, parece que o efeito dos LC n-3 PUFAs no anabolismo da musculatura esquelética em indivíduos mais velhos é incerto e contraditório.
TREINOS COM EXERCÍCIOS DE ENDURANCE
Além da membrana fosfolipídica externa da musculatura esquelética (sarcolema), a suplementação com LC n-3 PUFAs impacta na composição lipídica de outras membranas reguladoras fundamentais da célula, como a mitocôndria (Herbst et al., 2014). Membranas mitocondriais também exibem diferentes respostas após a suplementação com LC n-3 PUFAs, em comparação com as membranas sarcolemais, com as membranas mitocondriais parecendo ser mais suscetíveis à ingestão de LC n-3 PUFAs (Gerling et al., 2019). Já que a fosforilação oxidativa, o processo de produção de trifosfato de adenosina (ATP) utilizando difosfato de adenosina (ADP), fosfato inorgânico (Pi) e oxigênio, ocorre na mitocôndria, o efeito diferenciado da ingestão de LC n-3 PUFAs nas membranas sarcolemais e mitocondriais poderia ser fisiologicamente relevante no contexto do exercício de endurance. Neste sentido, 12 semanas de suplementação com 2 g/dia de EPA e 1 g/dia de DHA em homens jovens aumentou a sensibilidade ao ADP (Herbst et al., 2014), enquanto outros estudos mostraram que a suplementação com LC n-3 PUFAs pode diminuir o consumo de oxigênio no exercício (Hingley et al., 2017). Além disso, trabalhos com roedores mostram que a ingestão de LC n-3 PUFAs também reduz o consumo de oxigênio dos membros posteriores durante a contração (Peoples & McLennan, 2010). Apesar da possibilidade dos LC n-3 PUFAs em aumentar a sensibilidade mitocondrial ao ADP e reduzir o consumo de oxigênio durante o exercício, existem poucas evidências de que a ingestão de LC n-3 PUFAs seja traduzida em um efeito ergogênico na performance no exercício de endurance (Lewis et al., 2020).
Apesar de evidências existentes sugerirem que a ingestão de LC n-3 PUFAs não impacta positivamente na performance no exercício de endurance, é importante notar que praticamente todos os estudos nesta área são conduzidos com jovens adultos (Heileson & Funderburk, 2020; Lewis et al., 2020). Esta distinção é importante porque pode haver diferenças fundamentais na fisiologia de indivíduos mais jovens e mais velhos que possuam uma relação direta nesta área. Por exemplo, não se sabe se indivíduos mais velhos necessitam de maior dose relativa de LC n-3 PUFAs para induzir as alterações nas membranas celulares em comparação com indivíduos mais jovens. Outra consideração, talvez mais sólida, é de que os LC n-3 PUFAs podem apresentar efeitos ergogênicos apenas na presença de disfunções, ou com estado de LC n-3 PUFAs abaixo do ideal. De fato, a disfunção mitocondrial é frequentemente relacionada com a saúde musculoesquelética prejudicada em indivíduos mais velhos. Em trabalhos anteriores apresentando maior tamanho muscular com a ingestão de LC n-3 PUFAs por 6 meses em indivíduos mais velhos (Smith et al., 2015), também foram identificados aumentos na transcrição mitocondrial (Yoshino et al., 2016). Então, enquanto a ingestão de LC n-3 PUFAs por indivíduos mais novos pode ser ineficiente em promover a performance no exercício de endurance, é possível que a ingestão de LC n-3 PUFAs, maior do que as recomendações para população, possa apresentar benefícios para os atletas master.
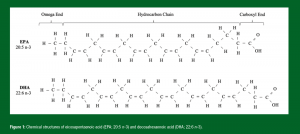
Figura 1: Estruturas químicas do ácido eicosapentaenoico (EPA; 20:5 n-3) e do ácido docosa-hexaenoico (DHA; 22:6 n-3).
Tradução:
Final ômega // Cadeia hidrocarbonada // Final carboxila
O ESTADO DE LC N-3 PUFAS
Uma medida comumente utilizada do estado de LC n-3 PUFAs é conhecida como índice de ômega-3, e foi desenvolvida para avaliar o risco de doença arterial coronariana em grande parte de dados epidemiológicos de indivíduos que já possuíam fatores de risco cardiometabólico (Harris & Von Schacky, 2004). O índice de ômega-3 é o conteúdo de EPA + DHA na membrana de uma célula vermelha do sangue como porcentagem de ácidos graxos contida naquela membrana (von Schacky, 2015). Indivíduos com um índice de ômega-3 < 4% são considerados de alto risco, enquanto aqueles com um índice de ômega-3 > 8% são considerados baixo risco. Fundamentalmente, sabe-se que aproximadamente 25% dos adultos canadenses com idades entre 60 e 70 anos, e aproximadamente 50% dos adultos canadenses com idades entre 20 e 39 anos, possuem um índice de ômega-3 < 4% (Demonty et al., 2021), com números semelhantes observados nos Estados Unidos (Murphy et al., 2015). Um estudo transversal recente com 1528 atletas universitários identificou uma média de índice de ômega-3 de 4,3%, com nenhum participante atingindo a marca de 8% (Ritz et al., 2020). De forma conjunta, estes achados sugerem que tanto adultos mais novos quanto mais velhos poderiam se beneficiar da maior ingestão de EPA+DHA (Demonty et al., 2021; Murphy et al., 2015; Ritz et al., 2020). Na verdade, uma nova análise das alterações no conteúdo de EPA+DHA nos lipídios sanguíneos em resposta à ingestão de LC n-3 PUFAs do nosso próprio trabalho sugere uma forte relação entre o estado basal de LC n-3 PUFAs e a alteração em resposta à suplementação com LC n-3 PUFAs, tanto em indivíduos mais velhos (Murphy et al., 2021) quanto mais novos (McGlory et al., 2014) (Figura 2). Em suma, aqueles que apresentam um baixo estado basal de LC n-3 PUFAs anteriormente à suplementação, possuem um aumento maior após a suplementação com LC n-3 PUFAs.
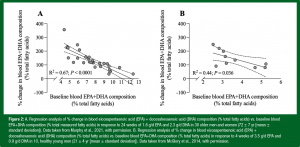
Figura 2: A. Análise de regressão da % de alteração na composição sanguínea de ácido eicosapentaenoico (EPA) + ácido docosa-hexaenoico (DHA) (% de ácidos graxos totais) versus composição sanguínea basal de EPA + DHA (% de ácidos graxos totais mensurados) em resposta a 24 semanas de 1,6 g/dia de EPA e 2,3 g/dia de DHA em 30 homens e mulheres mais velhos (72 ± 7 anos [média ± desvio padrão]). Dados retirados de Murphy et al., 2021, com permissão. B. Análise de regressão da % da alteração na composição sanguínea do ácido eicosapentaenoico (EPA) + ácido docosa-hexaenoico (DHA) (% de ácidos graxos totais) versus composição sanguínea basal de EPA + DHA (% de ácidos graxos totais) em resposta a 4 semanas de 3,5 g/dia de EPA e 0,9 g/dia de DHA em 10 homens jovens saudáveis (21 ± 4 anos [média ± desvio padrão]). Dados retirados de McGlory et al., 2014, com permissão.
Tradução:
% alteração na composição sanguínea de EPA + DHA (% ácidos graxos totais)
Composição sanguínea basal de EPA + DHA (% ácidos graxos totais)
Apesar do índice de ômega-3 estar recebendo um interesse significativo nas pesquisas, inúmeras questões devem ser consideradas quando se avalia a relevância do índice de ômega-3 na área das ciências do esporte e do exercício. Primeiro, a relação entre o índice de ômega-3 e a performance/recuperação do exercício está longe de ser conclusiva, com poucos dados mostrando uma correlação positiva entre os dois fatores. Em segundo lugar, o índice de ômega-3 foi desenvolvido predominantemente com base em indivíduos que já possuíam fatores de risco cardiometabólico, então a relevância para atletas saudáveis no contexto do risco cardiovascular é questionável (Harris & Von Schacky, 2004). Terceiro, alterações na composição de LC n-3 PUFAs no sangue em resposta à suplementação com LC n-3 PUFAs não refletem necessariamente aquelas da musculatura esquelética, especialmente durante a fase inicial (< 4 semanas) da suplementação (McGlory et al., 2014). Isto porque, as alterações no perfil lipídico sanguíneo ocorrem mais rapidamente após a ingestão de LC n-3 PUFAs do que na musculatura esquelética (McGlory et al., 2014). Finalmente, o índice de ômega-3 é uma medida do conteúdo de EPA+DHA na membrana de uma célula vermelha do sangue como porcentagem de 26 ácidos graxos medidos naquela membrana (von Schacky, 2015). Então, é importante garantir que a análise lipídica da amostra sanguínea da qual o índice de ômega-3 será calculado seja conduzida por laboratórios qualificados, ou aqueles com padrões analíticos capazes de capturar todos os 26 ácidos graxos. Contudo, apesar das limitações mencionadas anteriormente, o índice de ômega-3 é um biomarcador útil e prático do estado de LC n-3 PUFAs em humanos (Ritz et al., 2020), e futuros trabalhos que explorem como as alterações no índice de ômega-3 se relacionam com a performance e/ou recuperação do exercício são necessários neste momento.
FONTES DE LC N-3 PUFAS
PEIXES E FRUTOS DO MAR
Apesar da incerteza sobre a existência de um efeito ergogênico com a ingestão de LC n-3 PUFAs na performance do exercício, o que está claro é que os LC n-3 PUFAs são componentes essenciais da dieta dos seres humanos e muitos adultos mais velhos apresentam um baixo estado de LC n-3 PUFAs (Demonty et al. 2021). Certas pessoas mais velhas podem, portanto, se beneficiar com uma maior ingestão de LC n-3 PUFAs. A principal fonte de LC n-3 PUFAs na dieta são os peixes e frutos do mar. A maioria dos peixes contém EPA e DHA; no entanto, o conteúdo varia substancialmente entre as espécies e é maior em peixes gordurosos como o salmão e a cavala, médio em mariscos como as ostras e mexilhões e baixo em peixes brancos como o bacalhau e a pescada (Tabela 1). O conteúdo de EPA e DHA também varia entre as espécies dependendo das variáveis ambientais (por exemplo, maturidade e dieta). Peixes criados em cativeiro são geralmente alimentados com uma mistura de vegetais e óleos de peixe e tendem a ter maior quantidade total de lipídios e conteúdo de PUFA ômega-6, e uma menor proporção de LC n-3 PUFAs em comparação com os peixes selvagens. Em conjunto, estas diferenças resultam em quantidade semelhante de LC n-3 PUFAs por porção, dos peixes de cativeiro e selvagens (EFSA, 2005). A retenção de EPA e DHA em um peixe durante o cozimento é excelente (~85%) (Crowley & Gormley, 2018). Uma quantidade ligeiramente maior de LC n-3 PUFAs é perdida como resultado do processo de enlatamento (~24–49%); contudo, peixes gordurosos enlatados permanecem sendo uma boa fonte. Além do seu conteúdo de LC n-3 PUFAs, benefícios adicionais do consumo de peixes incluem o seu conteúdo de nutrientes necessários para uma melhor saúde e performance atlética como as proteínas, iodo, selênio, cálcio e vitaminas A, D e B12.

Referências – Valores retirados de: 1Banco de Dados em Alimentos e Nutrientes para Estudos Nutricionais 2017- 2018 Banco de Dados Central de Dados Alimentares (Departamento de Agricultura dos EUA, 2019), 2Dawczynski et al. (2007), 3van Ginneken et al. (2011), 4 Fleurence et al. (1994), 5 Banco de Dados Nacional em Nutrientes para Referência Padrão da USDA, 2018 Legado Central de Dados Alimentares (Departamento de Agricultura dos EUA, 2019), 6Website do fabricante. DHA, ácido docosa-hexaenoico; EPA, ácido eicosapentaenoico.
Tabela 1 – Conteúdo de LC n-3 PUFAs nos alimentos
| Quantidade | EPA (mg) | DHA (mg) | |
| Peixes e frutos do mar | |||
| Cavala, assada | 1 filé pequeno (170 g) | 1646 | 2666 |
| Arenque, defumado, | 3 filés pequenos (60 g) | 582 | 707 |
| Anchova, enlatada em óleo, drenada | 3 anchovas (12 g) | 92 | 155 |
| Salmão, enlatado em água, drenado | 1 lata drenada (177 g) | 655 | 1216 |
| Sardinha, enlatada em óleo, drenada | 1 lata drenada (92 g) | 435 | 468 |
| Lula, no vapor | 1 xícara (140 g) | 407 | 953 |
| Truta, no vapor | 1 filé pequeno (113 g) | 308 | 733 |
| Mexilhões, no vapor | 15 unidades (120 g) | 449 | 604 |
| Salmão, assado | 1 filé pequeno (170 g) | 389 | 712 |
| Ostra, crua | 3 unidades (36 g) | 64 | 49 |
| Alabote, assado | 1 filé pequeno (170 g) | 141 | 273 |
| Caranguejo, assado | 1 xícara (118 g) | 146 | 97 |
| Lagosta, no vapor | 1 lagosta média, apenas carne (295 g) | 342 | 227 |
| Camarão, no vapor | 1 xícara (145 g) | 126 | 129 |
| Pescada, no vapor | 1 filé pequeno (170 g) | 90 | 190 |
| Bacalhau, assado | 1 filé pequeno (170 g) | 73 | 206 |
| Atum, enlatado em óleo, drenado | 1 lata drenada (160 g) | 43 | 161 |
| Vieira, assada | 3 unidades (39 g) | 20 | 29 |
| Atum, fresco, no vapor | 1 filé pequeno (170 g) | 26 | 189 |
| Algas | |||
| Nori | Porção média (5 g) | 15-30 | 0 |
| Dulse (Palmaria palmata) | Porção média (5 g) | 17-41 | 0 |
| Carragena (alga irlandesa) | Porção média (5 g) | 1-6 | 0 |
| Wakame | Porção média (5 g) | 14-19 | 0 |
| Alimentos funcionais enriquecidos com LC n-3 PUFAs | |||
| Gordura vegetal tipo margarina, SMART BALANCE ômega plus | 1 porção em papel laminado (10g) | 31 | 32 |
| Ovos, enriquecidos com ômega 3, marca Sainsbury’s Woodland, galinhas criadas em liberdade | 1 ovo (50 g) | 3 | 75 |
ALIMENTOS FUNCIONAIS
Um número cada vez maior de produtos alimentícios é enriquecido com LC n-3 PUFAs (exemplo, certas marcas de ovos, pastas de amendoim, sucos, margarinas, pães, iogurte, leites e bebidas à base de soja). Estes alimentos podem ser fontes úteis de LC n-3 PUFAs para indivíduos que evitam peixes. O conteúdo de LC n-3 PUFAs de um alimento pode ser alterado pela adição de EPA e DHA durante o processo de fabricação ou através da alimentação dos animais com fontes de PUFAs n-3 de cadeia curta ou longa, levando a uma incorporação de LC n-3 PUFAs nos ovos, laticínios e produtos derivados da carne. Em geral, ovos de galinhas alimentadas com linhaça (rica em ácido α-linolênico (ALA)) contêm 60-100 mg DHA/ovo, enquanto ovos de galinhas alimentadas com microalgas fornecem 100-150 mg DHA/ovo. Alimentos enriquecidos podem variar consideravelmente em seus conteúdos de EPA e DHA. Portanto, os consumidores são aconselhados a checar os rótulos destes alimentos funcionais anteriormente à compra.
SUPLEMENTOS NUTRICIONAIS
Na medida do possível, indivíduos devem tentar atingir suas necessidades de LC n-3 PUFAs a partir dos alimentos. No entanto, os suplementos de LC n-3 PUFAs são úteis em situações em que isto não é possível. Os suplementos de LC n-3 PUFAs vêm em diversas fórmulas químicas (triglicérides, ácidos graxos livres, etil-ésteres, triglicérides re-esterificados e fosfolipídios) e são derivados de uma variedade de fontes (óleo de peixe, óleo de krill, óleo de fígado de bacalhau e óleo de algas). Um típico suplemento de óleo de peixe contém ~1000 mg de óleo de peixe, fornecendo 180 mg de EPA e 120 mg de DHA, mas as doses variam consideravelmente, variando de ~150 a 1300 mg de EPA + DHA por cápsula (Albert et al., 2015; Nichols et al., 2016). Alguns (Dyerberg et al., 2010), mas não todos os estudos (Hedengran et al., 2015), relatam uma maior biodisponibilidade de LC n-3 PUFAs fornecidos como triglicérides ou ácidos graxos livres em comparação com etil-ésteres. Um estudo recente relatou que as formulações com triglicérides resultaram em um aumento 1% maior no índice de ômega-3 em comparação com suplementos de etil-ésteres com a mesma dose de EPA + DHA, apesar de ambas as formulações terem sido efetivas em melhorar o estado de LC n-3 PUFAs (Walker et al., 2019).
Na escolha de suplementos, um suplemento com óleo de peixe ao invés do óleo de fígado de bacalhau é geralmente recomendado, já que o último tem alta quantidade de vitamina A, o que pode levar a ingestão excessiva, particularmente em populações de risco como gestantes. Veganos e vegetarianos podem escolher um suplemento contendo óleo de microalga, que normalmente fornece por volta de 100-300 mg de DHA por cápsula, com alguns suplementos contendo EPA também. Uma consideração prática adicional é consumir suplementos de LC n-3 PUFAs junto com uma refeição rica em gorduras para melhorar a absorção, especialmente quando o suplemento é uma formulação de etil-éster. Também deve ser notado que alguns estudos relataram que uma quantidade considerável de suplementos de LC n-3 PUFAs não contêm a quantidade de EPA + DHA comunicada no rótulo e/ou contêm produtos oxidados excedendo os níveis industriais padrão (Albert et al., 2015). Sobretudo, o impacto da oxidação de LC n-3 PUFAs em suas funções biológicas e consequências para a saúde precisam ainda ser estabelecidas.
APLICAÇÕES PRÁTICAS
- Atletas master devem consumir LC n-3 PUFAs de acordo com as recomendações atuais para a população geral para uma boa saúde (250-500 mg/dia). Apesar de haver algumas evidências de que uma ingestão maior pode melhorar as adaptações ao exercício de resistência, mais pesquisas são necessárias antes da possibilidade desta recomendação ser utilizada.
- O índice de ômega-3 é uma medida útil do estado de LC n-3 PUFAs; no entanto, há poucas evidências atualmente mostrando que ela está relacionada com a performance e/ou recuperação do exercício.
- A ingestão recomendada de LC n-3 PUFAs de 250-500 mg/dia pode ser atingida pelo consumo de 1 a 2 porções (100-140 mg/porção) de peixes gordurosos (como a cavala, sardinhas e salmão) por semana.
- Alimentos enriquecidos com LC n-3 PUFAs geralmente contêm substancialmente menos LC n-3 PUFAs por porção em comparação com o conteúdo de peixes, mas podem ser uma fonte valiosa entre os indivíduos que evitam comer peixes.
- Os suplementos de LC n-3 PUFAs são úteis quando quantidade adequada de LC n-3 PUFAs não pode ser consumida através da alimentação; no entanto, há certa preocupação de que alguns suplementos contenham produtos oxidados, com efeitos possivelmente adversos à saúde. Preferencialmente escolha suplementos que foram submetidos a testes em laboratórios independentes.
RESUMO
Em resumo, as evidências que respaldam um efeito ergogênico dos LC n-3 PUFAs para melhorar a resposta adaptativa da musculatura esquelética ao treino com exercícios de resistência em adultos mais velhos são contraditórias. As razões por trás destes resultados ambíguos são multifatoriais e podem estar relacionadas a diversas diferenças metodológicas entre os estudos, como a dosagem de LC n-3 PUFAs, o estado de LC n-3 PUFAs dos participantes e a ingestão habitual de proteínas. Não há evidências de que a ingestão de LC n-3 PUFAs melhore a performance nos exercícios de endurance em atletas master. Aproximadamente 25% dos adultos mais velhos apresentam um baixo estado de LC n-3 PUFAs, e assim estes indivíduos mais velhos poderiam se beneficiar de uma maior quantidade de LC n-3 PUFAs, consumidos tanto na forma de alimentos quanto através da suplementação.
Os pontos de vista expressos neste artigo são dos autores e não necessariamente refletem a posição ou políticas da PepsiCo, Inc.
REFERÊNCIAS
Albert, B.B., J.G. Derraik, D. Cameron-Smith, P.L. Hofman, S. Tumanov, S.G. Villas-Boas, and W.S. Cutfield (2015). Fish oil supplements in New Zealand are highly oxidised and do not meet label content of n-3 PUFA. Sci. Rep. 5:7928.
Anthony, R., M.J. Macartney, and G.E. Peoples (2021). The influence of long-chain omega-3 fatty acids on eccentric exercise-induced delayed muscle soreness: reported outcomes are compromised by study design issues. Int. J. Sport Nutr. Exerc. Metab. 31:143-153.
Bischoff-Ferrari, H.A., B. Vellas, R. Rizzoli, R.W. Kressig, J.A.P. da Silva, M. Blauth, and E.J. Orav (2020). Effect of vitamin D supplementation, omega-3 fatty acid supplementation, or a strength-training exercise program on clinical outcomes in older adults: the DO-HEALTH randomized clinical trial. J. Am. Med. Assoc. 324:1855-1868.
Burke, L.M., J.A. Hawley, S.H. Wong, and A.E. Jeukendrup (2011). Carbohydrates for training and competition. J. Sports Sci. 29 (Suppl 1):S17-S27.
Crowley, L., and R. Gormley (2018). Omega-3 status of farmed salmon. SeaHealth-ucd(27). Retrieved from https://www.ucd.ie/foodandhealth/t4media/SeaHealth%2027b.pdf
Da Boit, M., R. Sibson, R., S. Sivasubramaniam, J.R. Meakin, C.A. Greig, R.M. Aspden, and S.R. Gray (2017). Sex differences in the effect of fish-oil supplementation on the adaptive response to resistance exercise training in older people: a randomized controlled trial. Am. J. Clin. Nutr. 105:151-158.
Dawczynski, C., R. Schubert, and G. Jahreis (2007). Amino acids, fatty acids, and dietary fibre in edible seaweed products. Food Chem. 103:891–899.
Demonty, I., K. Langlois, L.S. Greene-Finestone, R. Zoka, and L. Nguyen (2021). Proportions of long-chain omega-3 fatty acids in erythrocyte membranes of Canadian adults: results from the Canadian Health Measures survey 2012-2015. Am. J. Clin. Nutr. 113:993-1008.
Dyerberg, J., P. Madsen, J.M. Møller, I. Aardestrup, and E.B. Schmidt (2010). Bioavailability of marine n-3 fatty acid formulations. Prostaglan. Leukot. Essent. Fatty Acids 83:137-141.
EFSA (2005). Opinion of the scientific panel on contaminants in the food chain on a request from the European parliament related to the safety assessment of wild and farmed fish. EFSA J. 236:1-118.
Fleurence, J., G. Gutbier, S. Mabeaul, and C. Leray (1994). Fatty acids from 11 marine macroalgae of the French Brittany coast. J. Appl. Phycol. 6:527-532.
Gerling, C.J., K. Mukai, A. Chabowski, G.J.F. Heigenhauser, G.P. Holloway, L.L. Spriet, and S. Jannas-Vela (2019). Incorporation of omega-3 fatty acids into human skeletal muscle sarcolemmal and mitochondrial membranes following 12 weeks of fish oil supplementation. Front. Physiol. 10:348.
Gingras, A.A., P.J. White, P.Y. Chouinard, P. Julien, T.A. Davis, L. Dombrowski, and M.C. Thivierge (2007). Long-chain omega-3 fatty acids regulate bovine whole-body protein metabolism by promoting muscle insulin signalling to the Akt-mTOR-S6K1 pathway and insulin sensitivity. J. Physiol. 579:269-284.
Harris, W.S., and C. Von Schacky (2004). The Omega-3 Index: a new risk factor for death from coronary heart disease? Prev. Med. 39:212-220.
Hedengran, A., P.B. Szecsi, J. Dyerberg, W.S. Harris, and S. Stender. (2015). n-3 PUFA esterified to glycerol or as ethyl esters reduce non-fasting plasma triacylglycerol in subjects with hypertriglyceridemia: a randomized trial. Lipids 50:165-175.
Heileson, J.L., and L.K. Funderburk (2020). The effect of fish oil supplementation on the promotion and preservation of lean body mass, strength, and recovery from physiological stress in young, healthy adults: a systematic review. Nutr. Rev. 78:1001-1014.
Herbst, E.A., S. Paglialunga, C. Gerling, J. Whitfield, K. Mukai, A. Chabowski, and G.P. Holloway (2014). Omega-3 supplementation alters mitochondrial membrane composition and respiration kinetics in human skeletal muscle. J. Physiol. 592:1341-1352.
Hingley, L., M.J. Macartney, M.A. Brown, P.L. McLennan, and G.E. Peoples (2017). DHA-rich fish oil increases the omega-3 index and lowers the oxygen cost of physiologically stressful cycling in trained individuals. Int. J. Sport Nutr. Exerc. Metab. 27:335-343.
Janssen, I. (2006). Influence of sarcopenia on the development of physical disability: the Cardiovascular Health Study. J. Am. Geriatr. Soc. 54:56-62.
Lewis, N.A., D. Daniels, P.C. Calder, L.M. Castell, and C.R. Pedlar (2020). Are there benefits from the use of fish oil supplements in athletes? A systematic review. Adv. Nutr. 11:1300-1314.
McGlory, C., S.D. Galloway, D.L. Hamilton, C. McClintock, L. Breen, J.R. Dick, and K.D. Tipton (2014). Temporal changes in human skeletal muscle and blood lipid composition with fish oil supplementation. Prostaglan. Leukot. Essent. Fatty Acids 90:199-206.
McGlory, C., S. van Vliet, T. Stokes, B. Mittendorfer, and S.M. Phillips (2018). The impact of exercise and nutrition on the regulation of skeletal muscle mass. J. Physiol. 597:1251-1258.
McGlory, C., P.C. Calder, and E.A. Nunes (2019). The influence of omega-3 fatty acids on skeletal muscle protein turnover in health, disuse, and disease. Front. Nutr. 6:144.
McKendry, J., L. Breen, B.J. Shad, and C.A. Greig (2018). Muscle morphology and performance in master athletes: A systematic review and meta-analyses. Ageing Res. Rev. 45:62-82.
McKendry, J., B.J. Shad, B. Smeuninx, S.Y. Oikawa, G. Wallis, C. Greig, and L. Breen (2019). Comparable rates of integrated myofibrillar protein synthesis between endurance-trained master athletes and untrained older individuals. Front. Physiol. 10:1084.
McKendry, J., S. Joanisse, S. Baig, B. Liu, G. Parise, C.A. Greig, and L. Breen (2020). Superior aerobic capacity and indices of skeletal muscle morphology in chronically trained master endurance athletes compared with untrained older adults. J. Gerontol. A Biol. Sci. Med. Sci. 75:1079-1088.
Murphy, C.H., E.M. Flanagan, G. De Vito, D. Susta, K.A.J. Mitchelson, E. de Marco Castro, J.M.G. Senden, J.P.B. Goessens, A. Mikłosz, A. Chabowski, R. Segurado, C.A. Corish, S.N. McCarthy, B. Egan, L.J.C. van Loon, and H.M. Roche (2021). Does supplementation with leucine-enriched protein alone and in combination with fish-oil-derived n-3 PUFA affect muscle mass, strength, physical performance, and muscle protein synthesis in well-nourished older adults? A randomized, double-blind, placebo-controlled trial. Am. J. Clin. Nutr. 113:1411-1427.
Murphy, R.A., E.A. Yu, E.D. Ciappio, S. Mehta, and M.I. McBurney (2015). Suboptimal plasma long chain n-3 concentrations are common among adults in the United States, NHANES 2003-2004. Nutrients 7:10282-10289.
Nichols, P.D., L. Dogan, and A. Sinclair, (2016). Australian and New Zealand fish oil products in 2016 meet label omega-3 claims and are not oxidized. Nutrients 8:703.
Peoples, G.E, and P.L. McLennan (2010). Dietary fish oil reduces skeletal muscle oxygen consumption, provides fatigue resistance and improves contractile recovery in the rat in vivo hindlimb. Br. J. Nutr. 104:1771-1779.
Ritz, P.P., M.B. Rogers, J.S. Zabinsky, V.E. Hedrick, J.A. Rockwell, E.G. Rimer, and M.S. Rockwell (2020). Dietary and biological assessment of the omega-3 status of collegiate athletes: a cross-sectional analysis. PLoS One 15:e0228834.
Rockwell, M., and P. Ritz (2021). Promoting optimal omega-3 fatty acid status in athletes. SSE #212.
Smith, G.I., P. Atherton, D.N. Reeds, B.S. Mohammed, D. Rankin, M.J. Rennie, and B. Mittendorfer (2011). Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin. Sci. 121:267-278.
Smith, G.I., S. Julliand, D.N. Reeds, D.R. Sinacore, S. Klein, and B. Mittendorfer (2015). Fish oil-derived n-3 PUFA therapy increases muscle mass and function in healthy older adults. Am. J. Clin. Nutr. 102:115-122.
The Scientific Advisory Committee on Nutrition (2004). The Scientific Advisory Committee on Nutrition and Committee on Toxicity advice on benefits and risks related to fish consumption. Retrieved from https://www.gov.uk/government/publications/sacn-advice-on-fish-consumption
U.S. Department of Agriculture (2019). FoodData Central. Available from U.S. Department of Agriculture, Agricultural Research Service FoodData Central Retrieved from fdc.nal.usda.gov.
US Department of Health and Human Services and US Department of Agriculture. (2015). 2015–2020 Dietary Guidelines for Americans. Retrieved from Washington, DC: https://health.gov/our-work/food-nutrition/2015-2020-dietary-guidelines/guidelines/
van Ginneken, V.J., J.P. Helsper, W. de Visser, H. van Keulen, and W.A. Brandenburg (2011). Polyunsaturated fatty acids in various macroalgal species from North Atlantic and tropical seas. Lipids Health Dis. 10:104.
von Schacky, C. (2015). Omega-3 fatty acids in cardiovascular disease–an uphill battle. Prostaglan. Leukot. Essent, Fatty Acids 92:41-47.
Walker, R.E., K.H. Jackson, N.L. Tintle, G.C. Shearer, A. Bernasconi, S. Masson, and W.S. Harris (2019). Predicting the effects of supplemental EPA and DHA on the omega-3 index. Am. J. Clin. Nutr. 110:1034-1040.
Witard, O.C., and J.K. Davis. (2021). Omega-3 fatty acids for training adaptation and exercise recovery: a muscle-centric perspective in athletes. SSE #211.
Yoshino, J., G.I. Smith, S.C. Kelly, S. Julliand, D.N. Reeds, and B. Mittendorfer (2016). Effect of dietary n-3 PUFA supplementation on the muscle transcriptome in older adults. Physiol. Rep. 4:e12785.






