SSE #226: BIOMARCADORES DO SUOR PARA APLICAÇÃO NA CIÊNCIA DO ESPORTE
Publicado em
July 2022
Autor
Lindsay B. Baker, Megan D. Engel, e Anthony S. Wolfe
PONTOS-CHAVE:
- Tem havido, recentemente, um interesse considerável no conceito de biomarcadores do suor, que é geralmente definido como a utilização do suor como uma alternativa não-invasiva à análise sanguínea, para fornecer insights sobre a fisiologia, saúde e performance humana.
- Contudo, a utilização de diagnósticos a partir do suor nas ciências esportivas tem sido limitada até o momento. Correlações entre o suor e o sangue ainda não foram estabelecidas para a maioria de seus constituintes. As concentrações de eletrólitos no suor não são necessariamente um biomarcador eficaz para a avaliação do estado de hidratação em tempo real (como, o balanço de líquidos).
- Utilizar o suor como biomarcador é desafiador porque a composição do suor não é apenas influenciada pelas concentrações extracelulares de solutos, mas também pelos mecanismos de secreção e/ou reabsorção, taxa de fluxo de suor, subprodutos do metabolismo da glândula sudorípara, contaminação da superfície da pele e secreções de sebo, assim como por fatores metodológicos e interindividuais.
- Estudos bem controlados fomentados de maneira adequada são necessários para determinar a relação entre as concentrações de solutos no suor e no sangue, o que irá ajudar a esclarecer a possível utilidade de diagnósticos a partir do suor como uma ferramenta não-invasiva para o monitoramento da hidratação, nutrição, e monitoramento fisiológico de atletas em tempo real.
INTRODUÇÃO
O propósito principal da transpiração é a termorregulação, já que a evaporação do suor da superfície da pele é o meio mais efetivo de liberar calor do corpo durante a prática de exercícios. Enquanto o suor é em grande parte água salgada (cloreto de sódio, NaCl), ele também contém muitos outros solutos dissolvidos, como as vitaminas, minerais-traço, metabólitos, citocinas e outros compostos. Os tipos de solutos no suor são comparáveis com os do sangue (apesar de em diferentes concentrações), porque o líquido extracelular funciona como fluido precursor do suor primário que é secretado inicialmente para dentro das glândulas écrinas (Cage & Dobson, 1965). Como resultado, há um interesse significativo na utilidade do suor, além do seu papel na regulação da temperatura corporal. Nos últimos 5 anos houve um aumento das pesquisas investigando a possibilidade do suor funcionar como uma ferramenta diagnóstica ou um biomarcador – por exemplo, uma alternativa não-invasiva à análise sanguínea para fornecer insights sobre a fisiologia, saúde e performance humana.
Muitas das pesquisas recentes sobre biomarcadores do suor foram conduzidas por avanços tecnológicos em materiais, mecânica e design de microssistemas, desta forma possibilitando a coleta e análise da composição química do suor in loco. No entanto, este conceito e prática de diagnóstico a partir do suor não são novos. Talvez o melhor exemplo de um biomarcador do suor seja a associação entre a alta concentração de cloreto no suor e a fibrose cística, que foi primeiramente reconhecida quase sete décadas atrás (Di Sant’Agnese et al., 1953). Contudo, fora a utilização do cloreto no suor para diagnosticar a fibrose cística, a aplicação dos biomarcadores do suor é limitada até o momento. Isto porque diversas questões sobre os mecanismos de secreção de solutos do suor e desafios metodológicos permanecem. Portanto, o propósito deste artigo do Sports Science Exchange é revisar: 1) os mecanismos básicos que determinam a composição do suor; e 2) evidências para a utilização do suor como indicador para as concentrações dos solutos sanguíneos. O objetivo é ajudar a elucidar quais constituintes do suor, se houverem, apresentam um potencial como biomarcador para o monitoramento da hidratação e do estado de nutrientes e fisiológico de atletas em tempo real, identificando lacunas na literatura, e indicando a direção de pesquisas futuras.
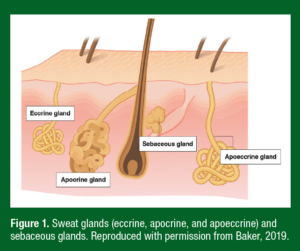
Figura 1. Glândulas sudoríparas (écrina, apócrina e apoécrina) e glândulas sebáceas. Reproduzido com permissão de Baker, 2019.
Tradução da figura:
Glândula écrina/ Glândula apócrina / Glândula Sebácea/ Glândula Apoécrina
Vídeo: SSE #226 Biomarcadores do Suor para Aplicações nas Ciências Esportivas
Pontos-chave / Apresentado por Anthony S. Wolfe, MS
Aqui estão os pontos principais para o nosso artigo do Sports Science Exchange com título “Biomarcadores do Suor para Aplicação na Ciênciado Esporte”. Há recentemente um interesse considerável no conceito dos biomarcadores do suor, que é geralmente definido como a utilização do suor como uma alternativa não-invasiva à análise sanguínea para fornecer insights sobre a fisiologia humana, saúde e performance. Contudo, a aplicação de diagnósticos a partir do suor nas ciências esportivas tem sido limitada até o momento. Correlações entre o sangue e o suor não foram estabelecidas para a maioria dos constituintes. Da mesma forma, as concentrações de eletrólitos no suor não são um biomarcador válido para a avaliação em tempo real do estado de hidratação por si só. Utilizar o suor como biomarcador é desafiador, porque a composição do suor não é apenas influenciada pelas concentrações extracelulares de solutos, mas também pelos mecanismos de secreção e/ou de reabsorção, taxa de fluxo de suor, subprodutos do metabolismo da glândula sudorípara, contaminação da superfície da pele e secreção de sebo, assim como outros fatores metodológicos e interindividuais. Estudos bem-controlados fomentados adequadamente são necessários para se determinar a relação das concentrações de soluto entre o suor e o sangue, o que irá então ajudar a informar a possível utilidade de diagnósticos a partir do suor como uma ferramenta não-invasiva para o monitoramento em tempo real da hidratação, nutrição e de questões fisiológicas em atletas.
TIPOS, ESTRUTURA E FUNÇÃO DAS GLÂNDULAS SUDORÍPARAS
As glândulas sudoríparas são classificadas em três tipos principais: écrinas, apócrinas e apoécrinas (Figura 1). As glândulas écrinas secretam uma solução aquosa composta principalmente de NaCl e são o tipo de glândula mais onipresente (~2-4 milhões pela maior parte da superfície do corpo). Glândulas apócrinas são limitadas predominantemente às axilas, seios, face e couro cabeludo e produzem um suor viscoso, rico em lipídios contendo proteínas, açúcares e amônia (Montagna & Parakkal, 1974a). Glândulas apoécrinas produzem secreções de água e sal, mas são apenas encontradas na região das axilas. Mesmo não sendo glândulas sudoríparas, as glândulas sebáceas estão presentes por grande parte da superfície do corpo, particularmente no couro cabeludo, testa e na face, onde elas secretam um fluido viscoso, rico em lipídios (Montagna & Parakkal, 1974b). As secreções das glândulas écrinas são geralmente as mais relevantes para a discussão dos biomarcadores do suor, já que a maioria dos estudos mede o suor dos braços, tórax, costas ou das pernas. Entretanto, alguns estudos coletam o suor da face e da testa e, portanto, neste caso as secreções das glândulas apócrinas e sebáceas também iriam contribuir para a composição do suor. Tanto as glândulas sebáceas como as apócrinas estão sob controle hormonal e acredita-se que suas secreções funcionem como feromônios. O sebo pode também apresentar propriedades antibacterianas e antifúngicas (Strauss et al., 1983).
A estrutura anatômica das glândulas sudoríparas do tipo écrina consiste em dois componentes funcionais principais: uma unidade secretora e um ducto, ambos formados por um simples epitélio tubular (Figura 2). Durante o exercício, uma grande quantidade de calor é produzida pela musculatura contrátil como um subproduto do metabolismo. O aumento resultante na temperatura corporal é detectado pelos termorreceptores da pele e centrais, que consequentemente estimulam o início da transpiração écrina, principalmente via sistema colinérgico simpático. As glândulas sudoríparas écrinas também respondem aos estímulos do exercício como o comando central, o reflexo pressor do exercício, os osmorreceptores, e possivelmente os barorreceptores (Shibasaki & Crandall, 2010). Mediante estimulação, as células claras da unidade secretora secretam o suor primário, o qual é praticamente isotônico em relação ao plasma sanguíneo considerando o Na+, o Cl– e o potássio (K+) (Costill, 1977). A função principal do ducto écrino é a reabsorção de íons de Na+ e Cl−, resultando em um suor final hipotônico excretado para a superfície da pele (Sato, 1977) (Figura 2).
ANÁLISE GERAL DA COMPOSIÇÃO DO SUOR
As concentrações aproximadas de alguns dos constituintes do suor, pesquisados mais comumente, são mostradas na figura 3. Apesar do suor conter uma mistura de muitos solutos, o Na+ e o Cl− são de longe os mais presentes, variando de 10 a 90 mmol/L (Barnes et al., 2019). Substâncias presentes em concentrações milimolares mais baixas incluem o lactato, a ureia, a amônia, o bicarbonato e o potássio. A maioria dos outros constituintes são medidos em micromolares (cálcio, magnésio, ferro, zinco, cobre, ácido ascórbico, glicose, ácido úrico e aminoácidos isolados), ou mesmo uma escala menor (nanomolar: tiamina, cortisol; picomolar: citocinas). Aproximações para as concentrações correspondentes no plasma sanguíneo também são mostradas na Figura 3. Poucos constituintes apresentam concentrações semelhantes no suor e no sangue (como o K+). Alguns solutos estão relativamente diluídos no suor devido à reabsorção no ducto (Na+, Cl−, bicarbonato), ou por limitações no transporte pelas e entre as células da glândula écrina (por exemplo, o ácido ascórbico, a glicose, as citocinas, o cortisol, o ácido úrico). Quando solutos aparecem no suor final em concentrações maiores do que as do sangue, a quantidade adicional de soluto poderia ser derivada da pele (como a ureia, a amônia, os aminoácidos, alguns minerais-traço), ou das glândulas sudoríparas écrinas (como o lactato, a ureia, a amônia). A próxima seção irá descrever os mecanismos fisiológicos e outros fatores que determinam as concentrações dos constituintes medidos no suor final.

Figura 2. Ilustração da estrutura da glândula sudorípara écrina e sua localização na pele (A), uma visão de perto da unidade secretora e do ducto (B), e os mecanismos de reabsorção de sódio e cloreto no ducto (C). Na+, sódio; K+, potássio; Cl–, cloreto; NaCl, cloreto de sódio; CFTR, canais Reguladores da Condutância Transmembranar da Fibrose Cística; ENaC, canal de sódio epitelial. Reproduzido com permissão de Baker, 2019.
Tradução da figura:
A: Poro // Estrato Córneo // Epiderme // Ducto Distal // Derme // Unidade Secretora e Ducto Proximal // Nervo Simpático
B: Suor final // Superfície da pele // Ducto // Reabsorção de NaCl // Unidade Secretora // Secreção do suor primário // Célula luminal // Célula basal // Célula escura // Célula clara // Célula mioepitelial
C: Lúmen // Suor // Célula luminal // Célula basal // Membrana basolateral // Membrana apical // transporte ativo // Transporte passivo
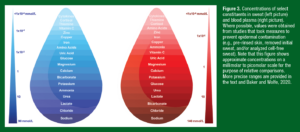
Figura 3. Concentrações dos constituintes selecionados no suor (figura da esquerda) e no sangue (figura da direita). Quando possível, os valores foram obtidos de estudos que realizaram medidas prevenindo a contaminação epidérmica (por exemplo, pele com enxágue prévio, remoção do suor inicial e/ou análise do suor livre de células). Note que esta figura mostra concentrações aproximadas em uma escala milimolar à picomolar com o propósito de comparações relativas. Intervalos mais precisos são fornecidas no texto e em Baker e Wolfe, 2020.
Tradução da figura:
(azul): Citocinas // Cortisol // Tiamina // Vitamina C // Zinco // Cobre // Ferro // Aminoácidos // Ácido Úrico // Glicose // Magnésio // Cálcio // Bicarbonato // Potássio // Amônia // Ureia // Lactato // Cloreto // Sódio
(vermelho): Citocinas // Tiamina // Cortisol // Aminoácidos // Zinco // Ferro / Cobre // Amônia // Vitamina C // Ácido Úrico // Magnésio // Cálcio // Potássio // Glicose // Ureia // Lactato // Bicarbonato // Cloreto // Sódio
REVISÃO DA LITERATURA
Sódio, Cloreto e Potássio
Mecanismos. A [Na+] e a [Cl−] no suor final são determinadas pela taxa de reabsorção de íons no ducto em relação à taxa de secreção de íons nas células claras da unidade secretora. O Na+, Cl−, e o K+ são secretados para a unidade secretora através do modelo cotransportador Na+-K+-2Cl−. A reabsorção do Na+ e do Cl− no ducto envolve o transporte passivo do Na+ através dos canais de Na+ epiteliais (ENaC) das células luminais, seguido pelo transporte ativo do Na+ (via Na+-K+-ATPase) através das células basais do ducto écrino (Sato, 1977). A reabsorção de Cl− é, em grande parte, passiva através do fluxo pelos canais Reguladores da Condutância Transmembranar da Fibrose Cística (CFTR), e ambas as células luminais e basais (Figura 2). A atividade da Na+-K+-ATPase e a abundância de canais CFTR têm um papel importante na determinação da [Na+] e [Cl−] no suor final. A atividade da Na+-K+-ATPase é influenciada pelo controle hormonal da aldosterona circulante (Sato & Dobson, 1970). A concentração plasmática da aldosterona em repouso (genômica) é influenciada pela aclimatação ao calor, condicionamento físico e dieta, enquanto fatores não-genômicos (como o exercício e a desidratação) estimulam alterações agudas na aldosterona circulante (Yoshida et al., 2006). A disponibilidade de CFTR é reduzida na presença de defeitos nos genes CFTR (fibrose cística) (Quinton, 1999), e há evidências de que indivíduos saudáveis com suor salgado podem também exibir menor presença de canais CFTR (Brown et al., 2011). A taxa de reabsorção de Na+ e Cl– também é fluxo dependente, de tal forma que há uma relação direta entre a taxa de transpiração e a [Na+] e [Cl–] no suor final. À medida que a taxa de suor aumenta, a taxa de secreção de Na+ e Cl– no suor primário aumenta proporcionalmente, mais que a taxa de reabsorção de Na+ e Cl– ao longo do ducto, portanto, levando a uma maior [Na+] e [Cl–] no suor final (Buono et al., 2008).
Evidências como Biomarcadores. Devido à grande variedade de fatores impactando as taxas de reabsorção de Na+ e de Cl– no ducto, as concentrações de eletrólitos no suor podem variar consideravelmente em um atleta e entre os atletas. Portanto, o teste de suor é recomendado para se determinar as taxas de suor individuais e as concentrações de eletrólitos no suor de cada atleta, para que os atletas possam seguir estratégias personalizadas de reposição de líquidos. Diversos métodos válidos de teste do suor foram descritos previamente, variando de métodos com base em laboratório para métodos mais práticos de campo (Baker SSE #161). O teste de suor neste sentido tradicional ajuda a determinar um risco do atleta para perdas significativas de fluidos e eletrólitos. Contudo, a utilidade das [Na+], [Cl−], e [K+] no suor como biomarcadores no contexto esportivo propriamente dito é questionável. Isto é, em parte, devido à falta de correlação entre as [Na+], [Cl−], e [K+] no suor e no sangue (Klous, de Ruiter, et al., 2021). Mesmo que o suor primário seja isotônico em relação ao sangue, a taxa de reabsorção de Na+ e Cl− no ducto écrino é independente das concentrações de eletrólitos no plasma. Por exemplo, aumentos agudos na intensidade do exercício de maneira isolada podem resultar em aumentos significativos na [Na+] no suor final (Buono et al., 2008), sem alterações da [Na+] no plasma (Klous, de Ruiter, et al., 2021). Além disso, aspectos genômicos impactando a aldosterona plasmática de repouso têm um papel mais importante na determinação da [Na+] no suor final do que a [Na+] no plasma (McCubbin et al., 2019; Yoshida et al., 2006).
Foi sugerido que as concentrações de eletrólitos no suor podem ser utilizadas como biomarcadores para a detecção da desidratação. No entanto, como discutido acima, a [Na+] e [Cl–] no suor podem variar consideravelmente, e a alteração no estado de hidratação é apenas um dos muitos fatores que podem ter um pequeno papel nesta variação. As [Na+], [Cl−], e [K+] no suor foram mostradas aumentar (Morgan et al., 2004), diminuir (Armstrong et al., 1985), ou não se alterar (Walsh et al., 1994) em resposta à desidratação durante o exercício e/ou no estresse térmico. Além disso, estudos demonstraram alterações significativas nas [Na+], [Cl−], e/ou [K+] no suor em resposta a variações na intensidade do exercício (Baker et al., 2019), no ambiente (Dziedzic et al., 2014), ou na dieta (McCubbin et al., 2019), apesar de pequenas alterações no estado de hidratação durante a prática de exercícios. Em conjunto, enquanto o teste do suor é útil para quantificar as perdas de NaCl durante o exercício, as concentrações de eletrólitos no suor não são biomarcadores válidos para o estado de hidratação necessariamente (como, balanço de líquidos).
Minerais-Traço e Vitaminas
Mecanismos. Poucos estudos investigaram os mecanismos da secreção de suor para micronutrientes diferentes do Na+, Cl−, e K+. Além disso, a medida de certos minerais no suor é com frequência confundida pela contaminação da superfície da pele, já que as concentrações de cálcio (Ca2+), ferro (Fe2+), magnésio (Mg2+), e zinco (Zn2+) no suor com grande presença de células são ≥ 2 vezes maiores que o suor sem a presença de células (Baker & Wolfe, 2020). Estudos que realizaram medidas para coletar o suor sem a presença de células sugerem que as concentrações de minerais-traço e vitaminas no suor final são semelhantes, ou menores, que as concentrações no plasma sanguíneo (Figura 3). A secreção de alguns elementos no suor primário é influenciada por quantas frações vinculadas versus frações livres dos minerais cruzam a membrana de dupla camada de lipídios das células claras na unidade secretora da glândula écrina. Íons livres com carga como o Ca2+ e Mg2+ são hidrofílicos, mas pequenos, então eles podem ser secretados rapidamente através da rota paracelular. Ao contrário, frações destes elementos vinculadas às proteínas podem não estar disponíveis tão prontamente para a secreção, ou ela pode ocorrer em uma taxa mais lenta. Isto pode explicar o porquê das [Ca2+] e [Mg2+] no suor livre de células serem mais semelhantes ao ionizado do que as mesmas concentrações totais no plasma (Gibinski et al., 1974). As vitaminas, o ácido ascórbico e a tiamina, são moléculas polares grandes e, portanto, podem entrar na unidade secretora através da rota paracelular, mas mais pesquisas são necessárias para elucidar seus mecanismos de secreção.
Evidência como Biomarcador. Há interesse na possibilidade de sensores de suor do tipo “wearable” (vestimenta) como medida não-invasiva do estado de micronutrientes para uma nutrição personalizada, o que poderia ser útil na detecção de deficiências/insuficiências nutricionais e como suporte na mudança de comportamento alimentar. Contudo, poucos estudos bem-controlados, devidamente desenvolvidos compararam as concentrações de minerais-traço e de vitaminas no suor em comparação ao sangue (Mickelsen & Keys, 1943; Vellar, 1968; Zhao et al., 2021). Curiosamente, a única correlação significativa relatada para minerais-traço foi entre a [Fe2+] no suor livre de células e a [Fe2+] sérica, apesar de o coeficiente de correlação ser pequeno (r = 0.37) (Vellar 1968a). Alguns estudos encontraram uma alteração significativa na [Fe2+] e [Zn2+] no suor associada com a ingestão alimentar (Milne et al., 1983; Prasad et al., 1963), mas estes estudos incluíram populações de pacientes com deficiências de minerais conhecidas, ou indivíduos saudáveis envolvidos em intervenções controladas desenvolvidas para esgotar os estoques de minerais e, consequentemente, repô-los. Não está claro se os testes de suor seriam sensíveis o suficiente para detectar flutuações menores no estado de micronutrientes. Dados preliminares coletados com biossensores “wearable” (vestimenta) inovadores sugerem que as concentrações de ácido ascórbico, Zn2+, Ca2+, e Fe2+ no suor aumentaram após a suplementação oral em indivíduos saudáveis (Kim et al., 2022; Zhao et al., 2021). No entanto, os resultados sugerem uma tendência geral de aumento das concentrações em vez de uma relação linear com a ingestão (Kim et al., 2022). A administração oral de ácido ascórbico, Zn2+, Ca2+, e Fe2+ produzem grandes picos iniciais nas concentrações no suor (1-2 horas após consumo), seguido de reduções graduais nestas mesmas concentrações (Kim et al., 2022; Zhao et al., 2021). Mais trabalhos são necessários para se determinar a utilidade do suor como biomarcador para o estado de minerais-traço e de vitaminas.
Metabólitos
Mecanismos. A secreção de suor e a reabsorção de Na+ são processos ativos e a via principal de produção de energia para a função da glândula sudorípara é a fosforilação oxidativa da glicose e do glicogênio do plasma (Sato, 1977; Sato & Dobson, 1973). Desta forma, os subprodutos do metabolismo da glândula sudorípara podem ter um impacto na composição do suor final. Por exemplo, há um consenso geral de que, pelo menos, parte do lactato do suor tem origem na produção de lactato da glândula écrina. Consequentemente, o lactato pode ser transportado para fora das células claras através das proteínas transportadoras de monocarboxilato (Baker & Wolfe, 2020). A concentração de lactato no suor (5-40 mmol/L) normalmente excede aquela do lactato no sangue (0,5-2 mmol/L em repouso até 15-25 mmol/L durante o exercício), especialmente no começo da transpiração inicial, ou quando as taxas de fluxo estão baixas. A concentração de lactato no suor diminui à medida que a taxa de transpiração aumenta, possivelmente devido à diluição (Buono et al., 2010).
Enquanto a glicose está presente no suor, os mecanismos exatos da sua secreção não estão claros. A maioria dos estudos sugere que a glicose sanguínea é a fonte primária da glicose do suor. Contudo, as concentrações de glicose no suor são 100 vezes mais baixas que as do sangue (Boysen et al., 1984), provavelmente porque o seu grande tamanho e polaridade limitam a passagem da glicose para dentro da luz da glândula écrina. Por exemplo, um pouco da secreção de glicose pode ocorrer de forma paracelular, mas vias estreitas limitam o transporte de moléculas maiores. O fluxo transcelular da glicose para o suor pode ocorrer via transportadores de glicose (GLUT2, e transportadores SGLT3 e SGLT4 dependentes de sódio) (Baker & Wolfe, 2020), mas mais pesquisas são necessárias para elucidar estes mecanismos.
Tantos quantos 26 aminoácidos diferentes foram encontrados no suor na superfície da pele, mas as concentrações podem ser 3 vezes maiores ou iguais àquelas no sangue (Dunstan et al., 2016). Alguns dos aminoácidos constituintes do suor podem ter origem do plasma, com transferência para dentro da unidade secretora influenciada pelo peso molecular, polaridade ou vínculo de ligação, entre outros fatores (Baker & Wolfe, 2020; Gitlitz et al., 1974). A fonte não-plasmática de aminoácidos do suor são, provavelmente, fatores de hidratação naturais da pele (NMFs) e proteínas epidérmicas (Mark & Harding, 2013). Como respaldo a este fato, diversos estudos relataram um declínio na concentração de aminoácidos no suor à medida que a duração do exercício, ou a taxa de transpiração aumentem, sugerindo uma possível lavagem da pele, ou diluição da concentração de aminoácidos em consequência de maiores volumes de suor (Dunstan et al., 2016; Gitlitz et al., 1974).
O bicarbonato está presente na maioria dos fluidos corporais e tem um papel importante no balanço ácido-básico. Mecanismos secretórios não estão claros, mas podem envolver canais de bicarbonato/Cl- (Best2) em células escuras e trocadores de bicarbonato/Cl- em células luminais da unidade secretora (Cui & Schlessinger, 2015; Quinton & Reddy, 1989). O bicarbonato do suor (0,5-5 mmol/L) é mais baixo do que concentrações no sangue (22-29 mmol/L). Isto porque o bicarbonato é reabsorvido no ducto écrino, possivelmente via CFTR em conjunto com a secreção de H+ e trocadores de bicarbonato/Cl- nas células luminais, o que também leva a acidificação do suor final (Choi et al., 2001). Sendo assim, a taxa de secreção e reabsorção de bicarbonato nas glândulas écrinas determina o pH do suor final. Além disso, muito parecido com o Na+ e Cl−, a reabsorção de bicarbonato é inversamente relacionada à taxa de suor. Portanto, menores taxas de fluxo de suor estão associadas com uma menor concentração de bicarbonato e menor pH no suor final (Kaiser et al., 1974).
Evidência como Biomarcador. Há um interesse considerável no lactato e outros metabólitos do suor como uma alternativa mais prática e não-invasiva à amostragem de sangue. Por exemplo, a concentração plasmática de lactato é com frequência utilizada como um biomarcador para se determinar o limiar anaeróbico, utilizado como uma métrica importante para monitorar o nível e tipo de treino, e desenvolver regimes de exercício para a performance atlética. Contudo, há atualmente pouca à nenhuma evidência de uma correlação entre os metabólitos do suor e do sangue, incluindo o lactato, a glicose, aminoácidos, e o bicarbonato em indivíduos saudáveis em repouso, ou durante o exercício (Baker & Wolfe, 2020; Buono et al., 2010; Klous, de Ruiter, et al., 2021). Por exemplo, um aumento na concentração de lactato sanguíneo durante o exercício foi associado com uma redução (Ament et al., 1997; Klous, de Ruiter, et al., 2021), ou nenhuma alteração (Alvear-Ordenes et al., 2005; Green et al., 2000) na concentração correspondente de lactato no suor.
Alguns estudos não relataram resultados correlacionados, mas observaram alteração na concentração de metabólitos no suor após manipulação das concentrações sanguíneas através da ingestão de substratos. A concentração de bicarbonato no suor induzida pelo exercício não foi diferente após a ingestão de bicarbonato de sódio em comparação com o placebo, mas o pH do suor foi significativamente maior no ensaio com ingestão de bicarbonato de sódio (Patterson et al., 2002). Aumentos consideráveis nas concentrações de glicose no suor foram observados em resposta à infusão e à ingestão de uma dose bolus de glicose, o que causou um aumento na glicose sanguínea de 60 para 360 mg/dl (Boysen et al., 1984). Contudo, não está claro se alterações menores na glicose sanguínea iriam desencadear alterações mensuráveis concomitantes na glicose do suor.
A falta de correlação entre as concentrações de metabólitos no suor e no sangue talvez não seja uma surpresa, devido aos efeitos conhecidos da reabsorção no ducto (bicarbonato), limitações no transporte (glicose), e outros fatores (aminoácidos derivados da pele ou lactato derivado das glândulas) discutidos anteriormente. Enquanto alguns dados preliminares coletados com novos dispositivos “wearable” (vestimenta) relataram correlações significativas entre a glicose e o lactato no suor e no sangue, a interpretação dos resultados é difícil, em parte, devido a questões metodológicas, ao pequeno tamanho da amostra, ou à análise e comunicação dos resultados não serem claras ou estarem incompletas (para revisão veja Baker & Wolfe, 2020). Tem-se sugerido que a incorporação de algoritmos para calibrar as diferenças individuais e explicar o lapso de tempo entre o sangue e o suor, entre outros fatores, pode ajudar a melhorar as correlações. No entanto, ensaios clínicos bem desenhados são necessários para respaldar estas hipóteses. Até lá, a utilidade da análise do suor como indicador para o monitoramento dos metabólitos no sangue permanece questionável.
Resíduos de Nitrogênio
Mecanismos. Resíduos de nitrogênio como a ureia, o ácido úrico, e a amônia são produtos finais do metabolismo do nitrogênio no fígado. A remoção dos resíduos de nitrogênio é crucial para o funcionamento adequado do corpo, e ocorre principalmente através da eliminação pela urina. O principal composto formado a partir da oxidação da proteína é a ureia, a qual é uma pequena molécula polar que cruza facilmente a parede glandular e a membrana celular (Komives et al., 1966). Concentrações de ureia relatadas no suor (4-12 mmol/L) são frequentemente maiores que àquelas no plasma (2,5-7 mmol/L), sugerindo possíveis contribuições de fontes não-plasmáticas. A ureia aumentada no suor tem origem hipotética da ureia da epiderme (Brusilow, 1967), ou da produção de ureia proveniente da quebra da arginina em ornitina e ureia, através da atividade da arginase na glândula écrina ou na pele (Sato et al., 1989). De fato, pesquisas mostram que a proporção de ureia no suor em relação ao sangue diminui cerca de uma unidade após transpiração abundante, o que se acredita eliminar metabólitos como a ureia com origem na pele e na própria glândula (Komives et al., 1966). Evidências recentes da expressão do transportador de ureia (subtipos UT-A1 e UT-B1) na unidade secretora e no ducto da glândula écrina sugerem que pode haver também um mecanismo ativo de excreção da ureia pelo suor, possivelmente explicando a maior concentração de ureia no suor na presença de doença renal em estágio terminal (Xie et al., 2017). O ácido úrico é um subproduto do metabolismo da purina, que está relacionado com o turnover e degradação de trifosfato de adenosina (ATP) durante o exercício. Enquanto o ácido úrico aparece no suor, os mecanismos de secreção na glândula écrina são desconhecidos. Estudos mostram que as concentrações de ácido úrico no suor são aproximadamente 10 vezes menores que as do sangue (Huang et al., 2002; Yang et al., 2020). Provavelmente, isto acontece pelo transporte limitado através das membranas celulares devido ao grande tamanho molecular do ácido úrico.
A amônia é um resíduo formado principalmente por bactérias nos intestinos durante a digestão de proteínas e é utilizada como substrato no ciclo da ureia. Como a ureia, a amônia é uma pequena molécula polar, e sua secreção pode ocorrer através da difusão passiva via transporte transcelular ou paracelular. Além disso, a amônia é encontrada normalmente em maiores concentrações no suor (108 mmol/L) do que no sangue (0,01-0,03 mmol/L). Enquanto os exatos mecanismos implícitos para essas elevadas concentrações no suor não estão claros, tem sido sugerido que o suor final poderia ser impactado pela produção de amônia na glândula écrina via quebra da ureia e/ou formação de amônia na pele (Brusilow & Gordes, 1968; Nose et al., 2005), assim como pela amônia plasmática (Czarnowski et al., 1992).
Evidência como Biomarcador. A concentração de amônia no sangue aumenta com o esforço físico e atividade muscular e elevações na ureia estão associadas com o catabolismo de proteínas. Portanto, acredita-se que a amônia e a ureia do suor podem ser marcadores úteis para o estresse metabólico relacionado com o exercício. A concentração de amônia no suor induzido farmacologicamente foi mostrada aumentar, concomitantemente com as concentrações elevadas de amônia no sangue, após a ingestão oral de cloreto de amônio (Czarnowski et al., 1992). No entanto, em um estudo sobre o exercício, a maior concentração de amônia no sangue resultante de maiores taxas de esforço levou a uma redução significativa na concentração de amônia no suor (Ament et al., 1997). Além disso, há poucas evidências de uma correlação entre as concentrações de amônia, ureia ou ácido úrico no suor e no sangue (Yang et al., 2020), principalmente em um contexto relevante para atletas saudáveis (Huang et al., 2002; Klous, de Ruiter, et al., 2021). Um estudo encontrou correlações significativas entre o suor e o sangue quando exercícios (partida de rugby) e sessões de sauna (antes e após a partida) foram realizados para estimular a transpiração, mas as concentrações de amônia e ureia no suor apenas representaram respectivamente 7% e 45% da variação nas concentrações sanguíneas relacionadas (Alvear-Ordenes et al., 2005). Mais estudos bem controlados de correlação em um contexto esportivo são necessários.
Tem-se sugerido que a transpiração induzida pelo calor pode servir como caminho importante para excreção de ácido úrico e de ureia em momentos de maior produção e de concentrações séricas elevadas. As concentrações de ácido úrico no suor têm sido maiores em pacientes com gota em comparação aos indivíduos saudáveis (Yang et al., 2020). Contudo, as perdas totais de ácido úrico no suor em indivíduos saudáveis, incluindo após estresse térmico e exercício prolongados, são muito baixas (< 5-10%) em comparação com a quantidade excretada normalmente pela micção (Huang et al., 2002).
Marcadores Imunológicos e do Estresse
Mecanismos. Cortisol age como o principal hormônio glicocorticoide produzido pelo córtex adrenal, sendo liberado em resposta a estímulos psicológicos e fisiológicos. Aproximadamente 90% do hormônio endógeno é ligado a transportadores, enquanto o restante, 5%-10%, é na forma de cortisol livre. Acredita-se que o cortisol livre possa se dissipar facilmente para dentro das células, devido a sua membrana celular rica em lipídios. Logo, a difusão passiva é, provavelmente, o mecanismo pelo qual o cortisol livre é secretado para dentro da glândula écrina. Isto pode explicar também o porquê de a concentração de cortisol no suor ser ~100 vezes menor que a no sangue, já que as frações vinculadas do cortisol não são secretadas tão prontamente como o cortisol livre (Jenkins et al., 1969).
As citocinas têm efeitos pleiotrópicos cruciais para a sinalização celular endócrina, autócrina, e parácrina relacionada à inflamação, à resposta imune e à infecção. Seu alto peso molecular parece inviabilizar sua secreção no suor écrino; no entanto, diversos estudos detectaram interleucinas (IL)-1α ou IL-1β, IL-6, IL-8, IL-10, IL-31, fator de necrose tumoral alfa (TNF)-α, e o fator de transformação do crescimento beta (TGF)-β no suor (Didierjean et al., 1990; Marques-Deak et al., 2006; Sato & Sato, 1994). É possível que as citocinas do suor sejam, pelo menos parcialmente, derivadas dos estoques circulantes, já que alguns estudos não encontraram diferenças estatísticas entre as concentrações no suor e as plasmáticas em repouso (Marques-Deak et al., 2006). Contudo, parece que as citocinas podem também ter origem das próprias glândulas sudoríparas já que as citocinas são expressas de maneira inata nas glândulas écrinas. Por exemplo, a glândula écrina foi mostrada expressar atividade imuno-histoquímica de várias citocinas (IL-1α, IL-1β, IL-6, IL-8, IL-31, TGF-β, e TNF-α), assim como a codificação do mRNA em estudos de hibridização ((IL-1α, IL-1β, IL-8, TNF-α) (Baker & Wolfe, 2020). Além disso, as concentrações elevadas de citocinas no suor durante o estresse no exercício e térmico (Didierjean et al., 1990; Sato & Sato, 1994) indicariam secreção de citocinas induzida pelo estresse, ao invés de ter origem no sangue. De qualquer maneira, mais pesquisas são necessárias para elucidar os possíveis mecanismos do transporte de citocinas a partir do plasma, assim como a produção pelas glândulas écrinas.
Evidência como Biomarcador. Como o cortisol da saliva, há um interesse em utilizar o cortisol do suor como um biomarcador não-invasivo para o monitoramento do estresse e distúrbios relacionados com o ciclo circadiano para auxiliar na prevenção de doenças, ou acelerar sua recuperação. O cortisol do suor segue um padrão diurno (Kim et al., 2020), e as concentrações foram mostradas ser semelhantes às concentrações de cortisol na saliva (Russell et al., 2014; Torrente-Rodriguez et al., 2020). Contudo, apenas um estudo comparou as concentrações de cortisol no suor em comparação com as concentrações no sangue. Em um estudo piloto, um dispositivo do tipo “wearable” (vestimenta) foi utilizado para medir o cortisol no suor durante o exercício, e um teste pressor frio foi desenvolvido para induzir o estresse físico. Quando todos os dados foram coletados (8 indivíduos, 4 pontos de coleta de dados em cada), houve uma correlação significativa entre as concentrações de cortisol no suor e a sérica (r=0,87), e no suor e na saliva (r=0,78) (Torrente-Rodriguez et al., 2020). Mais pesquisas são necessárias, no entanto, para determinar a utilidade do cortisol do suor como um biomarcador com aplicações em contextos esportivos.
Há interesse no potencial da utilização das citocinas do suor como biomarcadores não-invasivos para monitorar a função do sistema imune, ou inflamação local na pele. As concentrações de citocinas de amostras coletadas durante transpiração passiva (insensível) foram mostradas ser maiores em pacientes com distúrbio depressivo importante (Cizza et al., 2008), e com sintomas de influenza/resfriado (Jagannath et al., 2021) em comparação com controles saudáveis. Além disso, dois estudos do mesmo laboratório (Cizza et al., 2008; Marques-Deak et al., 2006) relataram correlações significativas entre as concentrações de citocinas (IL-1α, IL-1β, TNF-α, IL-6, IL-8, TGF-β) medidas na transpiração insensível (coletada em um período de 24 horas) e amostras plasmáticas (coletadas próximo do final do período de coleta do suor). Contudo, mais trabalhos são necessários para corroborar com estes resultados e determinar a utilidade das citocinas do suor como biomarcadores para atletas saudáveis e bem-estar.
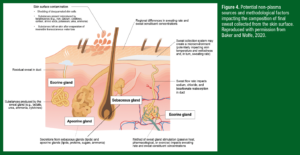
Figura 4. Potencial de fontes não-plasmáticas e fatores metodológicos de impactar na composição do suor final coletado da superfície da pele. Reproduzido com autorização de Baker e Wolfe, 2020.
Tradução da figura:
Contaminação da superfície da pele:
– Descamação de células da pele descamada
– Presença de substâncias nos e pelos queratinócitos (como o ferro, cálcio, citocinas, cortisol, aminoácidos, potássio, ureia e amônia)
– Substâncias deixadas na pele após a evaporação da perda insensível transcutânea de água
Diferenças regionais na taxa de suor e nas concentrações dos constituintes do suor
Sistema de coleta de suor pode criar um microambiente (possivelmente impactando na temperatura e umidade da pele, e por sua vez, na taxa de transpiração)
Taxa do fluxo de suor impacta na reabsorção de sódio, cloreto e bicarbonato no ducto
Método de estímulo da glândula sudorípara (calor passivo, farmacológico ou pelo exercício) impacta na taxa de transpiração e nas concentrações dos constituintes do suor
Secreção das glândulas sebáceas (lipídios) e apócrinas (lipídios, proteínas, açúcares e amônia)
Produção de substâncias pelas glândulas sudoríparas (exemplo, lactato, ureia, amônia e citocinas)
Suor residual no ducto
Glândula écrina // Glândula apócrina // Glândula sebácea // Glândula écrina
DESAFIOS
Porque o líquido extracelular é o líquido precursor do suor primário, todos aqueles componentes do plasma sanguíneo também são encontrados no suor final. Contudo, há muitos outros fatores ditando as concentrações de solutos no suor final coletado da superfície da pele, o que geralmente se enquadra em uma das três categorias: fontes não-plasmáticas, fatores metodológicos, e fatores entre indivíduos e interindividual. Como discutido previamente, algumas substâncias não se originam do suor precursor (por exemplo, fluído extracelular/plasma), mas ao invés disso entram na glândula sudorípara devido à produção pela glândula écrina, ou aparecem no suor final na superfície da pele pelo contato com os queratinócitos. Estas fontes não-plasmáticas de suor estão ilustradas na Figura 4.
Os fatores metodológicos que influenciam a taxa de fluxo de suor e sua composição incluem o modo de estímulo da transpiração, tipo de sistema de coleta do suor, e a região de coleta do suor (Figura 4). Enquanto muitos estudos com sensores “wearable” (vestimenta) coletam o suor durante a transpiração ativa (como no exercício), conforme discutido acima há também um interesse no monitoramento dos biomarcadores do suor durante o repouso e recuperação. Logo, alguns sensores “wearable” são desenhados para a coleta de volumes em microlitros de líquidos durante a transpiração passiva; acontecendo ou pelas perdas crônicas não-sensíveis, ou pela estimulação aguda através da combinação com um agente colinérgico (por exemplo, carbacol, pilocarpina etc.). No entanto, as taxas de suor durante o exercício podem ser 2-3 vezes maiores do que na transpiração passiva. O método de estímulo da transpiração também pode impactar nos eletrólitos do suor, minerais-traço, e nas concentrações de metabólitos. Por exemplo, as concentrações de metabólitos no suor normalmente são mais altas na transpiração ativa em comparação com a passiva, mas a interpretação destes resultados é difícil já que os dados são confundidos pelas diferenças entre as taxas de suor e outras limitações dos estudos (para revisão veja Baker & Wolfe, 2020).
Estudos com sensores têm empregado uma ampla variedade de abordagens para coletar o suor, incluindo patches adesivos, tatuagens temporárias, faixas de pulso, sensores externos de ponta do dedo, almofadas para o nariz nos óculos, e vestimentas. É desconhecido como o aparelho/material por si só poderia influenciar a taxa de fluxo de suor e a composição do suor, criando um microambiente localizado na superfície da pele coberta. Estudos sugerem que o efeito das técnicas padrão de coleta no microambiente da pele varia dependendo da duração da aplicação e da temperatura ambiental. A temperatura da pele é mais provável de estar elevada (em comparação com a pele descoberta) quando patches absorventes são usados por um tempo maior (por exemplo, 60 minutos), ou em ambientes amenos (Klous, Folkerts, et al., 2021). Uma maior temperatura da pele seria esperada em resultar em uma taxa de suor elevada. Em contrapartida, uma umidade elevada da pele causada pelo uso de cobertura obstrutiva por um período prolongado pode levar a hidromeiose, uma condição que causa um declínio gradual na taxa de suor (Collins & Weiner, 1962). Por fim, é bem conhecido que há diferenças regionais significativas na distribuição do suor e na sua composição. Estudos relataram diferenças ~3-6 vezes maiores em taxas de suor e diferenças ~2-4 vezes maiores nas concentrações de eletrólitos, minerais-traço, lactato, aminoácidos e bicarbonato por todo o corpo (Baker & Wolfe, 2020).
Fatores interindividuais, como o estado de aclimatação ao calor, dieta, doenças, medicamentos, tatuagens, sexo, idade/maturação, entre outros, podem apresentar efeitos adicionais nas concentrações de solutos do suor que poderiam confundir a interpretação dos resultados dependendo do biomarcador e interesse de aplicação. Contudo, o impacto destes fatores é, em grande parte, desconhecido para a maioria dos constituintes com talvez a exceção do Na+ e do Cl–, como discutido acima. Também é importante notar que alterações na intensidade do exercício, ou nas condições ambientais desencadeando alterações na taxa de suor provavelmente irão impactar na composição final do suor (especialmente o Na+, Cl–, lactato, ureia e bicarbonato) (Baker & Wolfe, 2020). Por fim, há uma grande variabilidade interindividual para muitos biomarcadores discutidos, mesmo quando medidos no sangue (como por exemplo, o cortisol). Desta forma, as medidas de referência e considerações para o lapso de tempo do fluxo de componentes da circulação para o suor podem também precisar serem considerados para a interpretação dos resultados.
CONCLUSÃO
Apesar dos recentes avanços tecnológicos nos dispositivos do tipo “wearable” e considerável interesse na utilização do suor como uma alternativa não-invasiva ao sangue, a aplicação de diagnósticos a partir do suor nas ciências esportivas é limitada até o momento. Isto acontece, ao menos em parte, porque interferências nas medidas da composição do suor e sua independência em relação às concentrações no sangue podem tornar desafiador saber se e quando interpretar as alterações na concentração dos constituintes do suor como fisiologicamente relevantes. A utilidade do suor como biomarcador pode depender da precisão necessária para a aplicação desejada – por exemplo, detectar grandes diferenças no estado de nutrientes através do suor pode ser mais plausível do que pequenas alterações em tempo real nas concentrações dos metabólitos no sangue. Além disso, ainda há desafios técnicos cruciais no campo dos sensores “wearable” de suor como lidar com um amplo conjunto de condições de fluxo, sensibilidade analítica, miniaturização, e necessidades de energia/memória para a operação contínua. Estudos futuros deveriam abordar estas lacunas importantes na literatura e explicar os fatores metodológicos essenciais para elucidar a possível utilização do suor como indicador sanguíneo e/ou como um biomarcador para o estado fisiológico/nutricional.
APLICAÇÕES PRÁTICAS
- Medir as concentrações de eletrólitos no suor é útil para quantificar perdas de NaCl como uma consequência da transpiração durante o exercício, mas não necessariamente como um biomarcador para a avaliação em tempo real do estado de hidratação (como, o balanço de líquidos).
- Concentrações de minerais-traço e vitaminas no suor geralmente aumentam após a administração oral, mas há poucos estudos bem controlados comparando o suor em comparação com o sangue.
- Há pouca à nenhuma evidência da correlação dos metabólitos, resíduos de nitrogênio, ou marcadores do estresse e imunológicos entre o suor e o sangue, especialmente em indivíduos saudáveis em repouso, ou durante o exercício.
- Alguns dados preliminares coletados com novos dispositivos “wearable” relataram correlações significativas entre o suor e o sangue para a glicose e o lactato, após a incorporação de algoritmos para calibrar as diferenças individuais e explicar a defasagem de tempo entre o suor e o sangue. No entanto, ensaios clínicos bem desenhados são necessários para corroborar com estes achados.
- As concentrações dos constituintes do suor são no mínimo parcialmente independentes das concentrações no sangue devido à reabsorção pelos ductos (Na+, Cl–, bicarbonato), ou pela produção pelas glândulas écrinas (exemplo, lactato, ureia, amônia, citocinas) ou na pele (exemplo, ureia, amônia, aminoácidos, Ca2+, Fe2+).
- Em pesquisas futuras é importante utilizar métodos de estimulação do suor que sejam adequados para a questão pretendida e aplicação dos dados (por exemplo, local ou de corpo inteiro, farmacológico ou térmico, repouso 24 horas versus exercício agudo).
Os autores são colaboradores do Instituto Gatorade de Ciências do Esporte, uma divisão do departamento de Pesquisa & Desenvolvimento da PepsiCo. Os pontos de vista expressos aqui são dos autores e não refletem necessariamente a posição ou as políticas da PepsiCo, Inc.
REFERÊNCIAS
Alvear-Ordenes, I., Garcia-Lopez, D., De Paz, J. A., & Gonzalez-Gallego, J. (2005). Sweat lactate, ammonia, and urea in rugby players. Int J Sports Med, 26(8), 632-637.
Ament, W., Huizenga, J. R., Mook, G. A., Gips, C. H., & Verkerke, G. J. (1997). Lactate and ammonia concentration in blood and sweat during incremental cycle ergometer exercise. Int J Sports Med, 18(1), 35-39.
Armstrong, L. E., Hubbard, R. W., Szlyk, P. C., Matthew, W. T., & Sils, I. V. (1985). Voluntary dehydration and electrolyte losses during prolonged exercise in the heat. Aviat Space Environ Med, 56(8), 765-770.
Baker, L. B., De Chavez, P. J. D., Ungaro, C. T., Sopena, B. C., Nuccio, R. P., Reimel, A. J., & Barnes, K. A. (2019). Exercise intensity effects on total sweat electrolyte losses and regional vs. whole-body sweat [Na(+)], [Cl(-)], and [K(+)]. Eur J Appl Physiol, 119(2), 361-375.
Baker, L. B., & Wolfe, A. S. (2020). Physiological mechanisms determining eccrine sweat composition. Eur J Appl Physiol, 120(4), 719-752.
Barnes, K. A., Anderson, M. L., Stofan, J. R., Dalrymple, K. J., Reimel, A. J., Roberts, T. J., Randell, R. K., Ungaro, C. T., & Baker, L. B. (2019). Normative data for sweating rate, sweat sodium concentration, and sweat sodium loss in athletes: An update and analysis by sport. J Sports Sci, 37(20), 2356-2366.
Boysen, T. C., Yanagawa, S., Sato, F., & Sato, K. (1984). A modified anaerobic method of sweat collection [Research Support, U.S. Gov’t, P.H.S.]. J Appl Physiol, 56(5), 1302-1307.
Brown, M. B., Haack, K. K., Pollack, B. P., Millard-Stafford, M., & McCarty, N. A. (2011). Low abundance of sweat duct Cl- channel CFTR in both healthy and cystic fibrosis athletes with exceptionally salty sweat during exercise. Am J Physiol Regul Integr Comp Physiol, 300(3), R605-615.
Brusilow, S. W. (1967). Evidence for a non-plasma source of urea in sweat. Nature, 214(5087), 506.
Brusilow, S. W., & Gordes, E. H. (1968). Ammonia secretion in sweat. Am J Physiol, 214(3), 513-517.
Buono, M. J., Claros, R., Deboer, T., & Wong, J. (2008). Na+ secretion rate increases proportionally more than the Na+ reabsorption rate with increases in sweat rate. J Appl Physiol (1985), 105(4), 1044-1048.
Buono, M. J., Lee, N. V., & Miller, P. W. (2010). The relationship between exercise intensity and the sweat lactate excretion rate. J Physiol Sci, 60(2), 103-107.
Cage, G. W., & Dobson, R. L. (1965). Sodium Secretion and Reabsorption in the Human Eccrine Sweat Gland. J Clin Invest, 44, 1270-1276.
Choi, J. Y., Muallem, D., Kiselyov, K., Lee, M. G., Thomas, P. J., & Muallem, S. (2001). Aberrant CFTR-dependent HCO3- transport in mutations associated with cystic fibrosis. Nature, 410(6824), 94-97.
Cizza, G., Marques, A. H., Eskandari, F., Christie, I. C., Torvik, S., Silverman, M. N., Phillips, T. M., Sternberg, E. M., & Group, P. S. (2008). Elevated neuroimmune biomarkers in sweat patches and plasma of premenopausal women with major depressive disorder in remission: the POWER study. Biol Psychiatry, 64(10), 907-911.
Collins, K. J., & Weiner, J. S. (1962). Observations on arm-bag suppression of sweating and its relationship to thermal sweat-gland ‘fatigue’. J Physiol, 161, 538-556.
Costill, D. L. (1977). Sweating: its composition and effects on body fluids. Ann N Y Acad Sci, 301, 160-174.
Cui, C. Y., & Schlessinger, D. (2015). Eccrine sweat gland development and sweat secretion. Exp Dermatol, 24(9), 644-650.
Czarnowski, D., Gorski, J., Jozwiuk, J., & Boron-Kaczmarska, A. (1992). Plasma ammonia is the principal source of ammonia in sweat. Eur J Appl Physiol Occup Physiol, 65(2), 135-137.
Di Sant’Agnese, P. A., Darling, R. C., Perera, G. A., & Shea, E. (1953). Abnormal electrolyte composition of sweat in cystic fibrosis of the pancreas; clinical significance and relationship to the disease. Pediatrics, 12(5), 549-563.
Didierjean, L., Gruaz, D., Frobert, Y., Grassi, J., Dayer, J. M., & Saurat, J. H. (1990). Biologically active interleukin 1 in human eccrine sweat: site-dependent variations in alpha/beta ratios and stress-induced increased excretion. Cytokine, 2(6), 438-446.
Dunstan, R. H., Sparkes, D. L., Dascombe, B. J., Macdonald, M. M., Evans, C. A., Stevens, C. J., Crompton, M. J., Gottfries, J., Franks, J., Murphy, G., Wood, R., & Roberts, T. K. (2016). Sweat Facilitated Amino Acid Losses in Male Athletes during Exercise at 32-34 degrees C. PLoS One, 11(12), e0167844.
Dziedzic, C. E., Ross, M. L., Slater, G. J., & Burke, L. M. (2014). Variability of Measurements of Sweat Sodium Using the Regional Absorbent Patch Method. Int J Sports Physiol Perform.
Gibinski, K., Zmudzinski, J. Z. J., Kumaszka, F., Giec, L., & Waclawczyk, J. (1974). Calcium transit to thermal sweat. Acta Biol Med Ger, 32(2-3), 199-204.
Gitlitz, P. H., Sunderman, F. W., Jr., & Hohnadel, D. C. (1974). Ion-exchange chromatography of amino acids in sweat collected from healthy subjects during sauna bathing. Clin Chem, 20(10), 1305-1312.
Green, J. M., Bishop, P. A., Muir, I. H., McLester, J. R., Jr., & Heath, H. E. (2000). Effects of high and low blood lactate concentrations on sweat lactate response. Int J Sports Med, 21(8), 556-560.
Huang, C. T., Chen, M. L., Huang, L. L., & Mao, I. F. (2002). Uric acid and urea in human sweat. Chin J Physiol, 45(3), 109-115.
Jagannath, B., Lin, K. C., Pali, M., Sankhala, D., Muthukumar, S., & Prasad, S. (2021). Temporal profiling of cytokines in passively expressed sweat for detection of infection using wearable device. Bioeng Transl Med, 6(3), e10220.
Jenkins, M. E., Rivarola, M. A., Brusilow, S. W., & Migeon, C. J. (1969). Excretion of 4-14C-cortisol and 1,2-3H-D-aldosterone in human thermal sweat. J Clin Endocrinol Metab, 29(8), 1102-1106.
Kaiser, D., Songo-Williams, R., & Drack, E. (1974). Hydrogen ion and electrolyte excretion of the single human sweat gland. Pflugers Arch, 349(1), 63-72.
Kim, J., Wu, Y., Luan, H., Yang, D. S., Cho, D., Kwak, S. S., Liu, S., Ryu, H., Ghaffari, R., & Rogers, J. A. (2022). A Skin-Interfaced, Miniaturized Microfluidic Analysis and Delivery System for Colorimetric Measurements of Nutrients in Sweat and Supply of Vitamins Through the Skin. Adv Sci (Weinh), 9(2), e2103331.
Kim, S., Lee, B., Reeder, J. T., Seo, S. H., Lee, S. U., Hourlier-Fargette, A., Shin, J., Sekine, Y., Jeong, H., Oh, Y. S., Aranyosi, A. J., Lee, S. P., Model, J. B., Lee, G., Seo, M. H., Kwak, S. S., Jo, S., Park, G., Han, S., . . . Rogers, J. A. (2020). Soft, skin-interfaced microfluidic systems with integrated immunoassays, fluorometric sensors, and impedance measurement capabilities. Proc Natl Acad Sci U S A, 117(45), 27906-27915.
Klous, L., de Ruiter, C. J., Scherrer, S., Gerrett, N., & Daanen, H. A. M. (2021). The (in)dependency of blood and sweat sodium, chloride, potassium, ammonia, lactate and glucose concentrations during submaximal exercise. Eur J Appl Physiol, 121(3), 803-816.
Klous, L., Folkerts, M., Daanen, H., & Gerrett, N. (2021). The effect of short and continuous absorbent patch application on local skin temperature underneath. Physiol Meas, 42(4).
Komives, G. K., Robinson, S., & Roberts, J. T. (1966). Urea transfer across the sweat glands. J Appl Physiol, 21(6), 1681-1684.
Mark, H., & Harding, C. R. (2013). Amino acid composition, including key derivatives of eccrine sweat: potential biomarkers of certain atopic skin conditions. Int J Cosmet Sci, 35(2), 163-168.
Marques-Deak, A., Cizza, G., Eskandari, F., Torvik, S., Christie, I. C., Sternberg, E. M., Phillips, T. M., & Premenopausal, O. W. A. D. S. G. (2006). Measurement of cytokines in sweat patches and plasma in healthy women: validation in a controlled study. J Immunol Methods, 315(1-2), 99-109.
McCubbin, A. J., Lopez, M. B., Cox, G. R., Caldwell Odgers, J. N., & Costa, R. J. S. (2019). Impact of 3-day high and low dietary sodium intake on sodium status in response to exertional-heat stress: a double-blind randomized control trial. Eur J Appl Physiol, 119(9), 2105-2118.
Mickelsen, O., & Keys, A. (1943). The composition of sweat, with special reference to the vitamins. J Biol Chem, 149, 479-490.
Milne, D. B., Canfield, W. K., Mahalko, J. R., & Sandstead, H. H. (1983). Effect of dietary zinc on whole body surface loss of zinc: impact on estimation of zinc retention by balance method. Am J Clin Nutr, 38(2), 181-186.
Montagna, W., & Parakkal, P. F. (1974a). Apocrine Glands. In W. Montagna & P. F. Parakkal (Eds.), The Structure and Function of Skin (Third ed., pp. 332-365). Academic Press, Inc.
Montagna, W., & Parakkal, P. F. (1974b). Sebaceous Glands. In W. Montagna & P. F. Parakkal (Eds.), The Structure and Function of Skin (Third ed., pp. 280-331). Academic Press, Inc.
Morgan, R. M., Patterson, M. J., & Nimmo, M. A. (2004). Acute effects of dehydration on sweat composition in men during prolonged exercise in the heat. Acta Physiol Scand, 182(1), 37-43.
Nose, K., Mizuno, T., Yamane, N., Kondo, T., Ohtani, H., Araki, S., & Tsuda, T. (2005). Identification of ammonia in gas emanated from human skin and its correlation with that in blood. Anal Sci, 21(12), 1471-1474.
Patterson, M. J., Galloway, S. D., & Nimmo, M. A. (2002). Effect of induced metabolic alkalosis on sweat composition in men. Acta Physiol Scand, 174(1), 41-46.
Prasad, A. S., Schulert, A. R., Sandstead, H. H., Miale, A., Jr., & Farid, Z. (1963). Zinc, iron, and nitrogen content of sweat in normal and deficient subjects. J Lab Clin Med, 62, 84-89.
Quinton, P. M. (1999). Physiological basis of cystic fibrosis: a historical perspective. Physiol Rev, 79(1 Suppl), S3-S22.
Quinton, P. M., & Reddy, M. M. (1989). Cl- conductance and acid secretion in the human sweat duct. Ann N Y Acad Sci, 574, 438-446.
Russell, E., Koren, G., Rieder, M., & Van Uum, S. H. (2014). The detection of cortisol in human sweat: implications for measurement of cortisol in hair. Ther Drug Monit, 36(1), 30-34.
Sato, K. (1977). The physiology, pharmacology, and biochemistry of the eccrine sweat gland. Rev Physiol Biochem Pharmacol, 79, 51-131.
Sato, K., & Dobson, R. L. (1970). The effect of intracutaneous d-aldosterone and hydrocortisone on human eccrine sweat gland function. J Invest Dermatol, 54(6), 450-462.
Sato, K., & Dobson, R. L. (1973). Glucose metabolism of the isolated eccrine sweat gland. II. The relation between glucose metabolism and sodium transport. J Clin Invest, 52(9), 2166-2174.
Sato, K., Kang, W. H., Saga, K., & Sato, K. T. (1989). Biology of sweat glands and their disorders. II. Disorders of sweat gland function. J Am Acad Dermatol, 20(5 Pt 1), 713-726.
Sato, K., & Sato, F. (1994). Interleukin-1 alpha in human sweat is functionally active and derived from the eccrine sweat gland. Am J Physiol, 266(3 Pt 2), R950-959.
Shibasaki, M., & Crandall, C. G. (2010). Mechanisms and controllers of eccrine sweating in humans. Front Biosci (Schol Ed), 2, 685-696.
Strauss, J. S., Downing, D. T., & Ebling, F. J. (1983). Sebaceous Glands. In L. A. Goldsmith (Ed.), Biochemistry and Physiology of the Skin (Vol. 1, pp. 569-595). Oxford University Press, Inc.
Torrente-Rodriguez, R. M., Tu, J., Yang, Y., Min, J., Wang, M., Song, Y., Yu, Y., Xu, C., Ye, C., IsHak, W. W., & Gao, W. (2020). Investigation of cortisol dynamics in human sweat using a graphene-based wireless mHealth system. Matter, 2(4), 921-937. https://doi.org/10.1016/j.matt.2020.01.021
Vellar, O. D. (1968). Studies on sweat losses of nutrients. I. Iron content of whole body sweat and its association with other sweat constituents, serum iron levels, hematological indices, body surface area, and sweat rate. Scand J Clin Lab Invest, 21(2), 157-167.
Walsh, R. M., Noakes, T. D., Hawley, J. A., & Dennis, S. C. (1994). Impaired high-intensity cycling performance time at low levels of dehydration. Int J Sports Med, 15(7), 392-398.
Xie, L., Jin, L., Feng, J., & Lv, J. (2017). The Expression of AQP5 and UTs in the Sweat Glands of Uremic Patients. Biomed Res Int, 2017, 8629783.
Yang, Y., Song, Y., Bo, X., Min, J., Pak, O. S., Zhu, L., Wang, M., Tu, J., Kogan, A., Zhang, H., Hsiai, T. K., Li, Z., & Gao, W. (2020). A laser-engraved wearable sensor for sensitive detection of uric acid and tyrosine in sweat. Nat Biotechnol, 38(2), 217-224.
Yoshida, T., Shin-ya, H., Nakai, S., Yorimoto, A., Morimoto, T., Suyama, T., & Sakurai, M. (2006). Genomic and non-genomic effects of aldosterone on the individual variation of the sweat Na+ concentration during exercise in trained athletes. Eur J Appl Physiol, 98(5), 466-471.
Zhao, J., Nyein, H. Y. Y., Hou, L., Lin, Y., Bariya, M., Ahn, C. H., Ji, W., Fan, Z., & Javey, A. (2021). A Wearable Nutrition Tracker. Adv Mater, 33(1), e2006444.






