SSE #169: SUPORTE NUTRICIONAL PARA LESÕES QUE REQUEREM REDUZIR A ATIVIDADE
Publicado em
July 2017
Autor
Kevin D. Tipton, PhD
PONTOS-CHAVE:
- A resposta inflamatória à uma lesão é uma parte importante e integral do processo de recuperação. Enquanto a inflamação excessiva ou prolongada pode ter consequências negativas, a resposta inflamatória em relação à maioria das lesões é necessária e é preciso cautela antes de se tentar utilizar intervenções nutricionais para combater a inflamação.
- A imobilização de membros devido à uma lesão resulta em uma perda repentina e severa de massa muscular, força e função muscular. A perda de massa muscular pela inatividade da musculatura resulta principalmente de um decréscimo global na síntese de proteína muscular e “resistência anabólica”, por exemplo, uma resposta diminuída à estimulação da síntese de proteína muscular por agentes anabólicos ou de “construção muscular”, incluindo os aminoácidos e a insulina.
- A ingestão de energia durante um período de imobilização se encontra frequentemente reduzida em relação ao normal, mas provavelmente este decréscimo não costuma ser tão grave o quanto se pode considerar inicialmente. A determinação cuidadosa do gasto e consumo energético durante a recuperação de uma lesão é um aspecto importante do gerenciamento nutricional.
- Uma redução repentina e severa na ingestão de proteínas após uma lesão relativamente grave – provavelmente em conjunto com um decréscimo voluntário na ingestão energética – irá levar a um balanço nitrogenado negativo que resulta na regeneração da lesão prejudicada e/ou em maior perda muscular durante períodos de atividade reduzida. A manutenção, ou mesmo um aumento, da quantidade absoluta da ingestão de proteínas durante períodos de atividade reduzida (g de proteína/kg massa corporal/d) e a ingestão energética são aspectos importantes do suporte nutricional em lesões.
- Há um fundamento teórico e/ou evidências preliminares da eficácia de diversos nutracêuticos, incluindo os ácidos graxos ômega-3, a leucina e a creatina, em combater a perda muscular durante a imobilização de membros e/ou nível de atividade física reduzido após a lesão. Porém, não apenas os dados disponíveis devem ser considerados preliminares, uma vez que o conhecimento da dose ideal, do momento correto de consumo e das consequências potencialmente danosas do uso desses nutracêuticos ainda é incipiente.
- Há também evidências preliminares e indiretas para o suporte nutricional em lesões além daqueles casos necessitando de imobilização de membros, por exemplo, as lesões cerebrais traumáticas (concussão) e as lesões musculares. No entanto, apesar das alegações de eficácia de muitos nutrientes, em particular misturas de proteínas e aminoácidos livres, a maior parte das evidências é imprecisa e neste momento não é prudente se realizar recomendações embasadas nestas evidências em relação a qualquer tipo de nutriente, para este tipo de lesão.
INTRODUÇÃO
Todo praticante de atividade física, dos atletas de elite aos que praticam por razões de saúde e lazer, pode entender a frustração de uma lesão induzida pelos exercícios. As lesões variam de arranhões muito pequenos a danos mais severos que necessitam de inatividade prolongada e/ou imobilização de membros. Desta maneira, há um grande número de interesse entre os praticantes de exercícios e esportes de utilizar intervenções que possam amenizar os impactos das lesões e aumentar as taxas de regeneração e recuperação. Entre outras intervenções, estratégias nutricionais para auxiliar a recuperação de lesões induzidas pelos exercícios têm sido consideradas. Infelizmente, apesar do volume de material escrito sobre o suporte nutricional em lesões induzidas pelos exercícios, a maioria das informações disponíveis são baseadas em especulação – quase uma esperança – e muito poucas recomendações são respaldadas em dados provenientes de estudos diretamente examinando a nutrição em indivíduos lesionados (Tipton, 2015). Este artigo do Sports Science Exchange (SSE) irá discutir as evidências para o suporte de atletas lesionados e praticantes de atividade física através da nutrição e tentar realizar recomendações baseadas em informações disponíveis.
A recuperação de lesões induzidas por exercícios pode ser considerada tendo dois principais estágios, ambos os quais podem ser influenciados por escolhas nutricionais. O primeiro estágio é o da regeneração e recuperação, caracterizado por uma resposta inflamatória inicial, regeneração da lesão, e quase que certamente, nível de atividade reduzida. Lesões mais severas podem também resultar em imobilização de membros e níveis de atividade drasticamente reduzidos. O segundo estágio acontece após o retorno às atividades e reabilitação. Frequentemente a linha entre estes dois estágios é de alguma forma indistinta, mas se a imobilização de um membro está envolvida, a transição de um estágio para o outro é geralmente muito clara. Infelizmente, parece evidente que a recuperação completa, especialmente o retorno completo às atividades e treinamentos, demora mais que o período de imobilização e/ou nível reduzido de atividade (Tipton, 2015). Claramente, o suporte nutricional apropriado pode ser fundamental para a redução do impacto negativo da lesão por si só, para a redução na atividade devido à uma lesão e possível imobilização de um membro, assim como para auxiliar o aumento nas atividades e reabilitação. Recomendações nutricionais para a reabilitação e o retorno completo aos treinamentos são similares àquelas realizadas para maior crescimento da musculatura (Phillips, 2014). Deste modo, esta discussão irá focar principalmente no primeiro estágio da recuperação de uma lesão, isto é, o momento quando as lesões estão sendo regeneradas e o nível de atividade se encontra reduzido, provavelmente devido à imobilização de um membro. Além disso, enquanto a maior parte da discussão irá centralizar em lesões que levam a imobilização de membros, também será feita uma tentativa de oferecer algumas informações sobre outros tipos de lesões.
RESPOSTA INFLAMATÓRIA
Uma resposta inflamatória imediata é iniciada após uma lesão induzida por exercícios. Esta resposta pode durar por algumas horas até muitos dias dependendo da severidade da lesão (Calder, 2013). Enquanto uma resposta inflamatória apropriada é um aspecto crucialmente importante da regeneração da lesão e deste modo da recuperação, comumente são realizadas recomendações nutricionais para diminuir a inflamação. As recomendações para a alta ingestão de nutrientes anti-inflamatórios e antioxidantes, como os ácidos graxos ômega-3 (n-3FA), vitaminas e fitonutrientes são frequentemente promovidas (Calder, 2013). No entanto, uma maior ingestão de nutrientes designados para controlar a inflamação após uma lesão deveria ser realizada com cautela. Já que a resposta inflamatória, por si só é fundamental para o início da máxima regeneração da lesão, atenuar esta resposta pode ser contraproducente. Além disso, características importantes da suplementação que visam reduzir a inflamação de forma ideal, como a dose, frequência e duração da ingestão dos nutrientes são desconhecidas. Deste modo, a não ser que existam evidências de inflamação excessiva e demasiadamente prolongada – pouco provável em atletas lesionados, porém saudáveis – é necessário se ter cautela em relação às intervenções que focam em eliminar a inflamação.
RESPOSTAS METABÓLICAS DURANTE A IMOBILIZAÇÃO DE MEMBROS E NÍVEL REDUZIDO DE ATIVIDADE
Uma das consequências mais complicadas de uma lesão induzida por exercícios é a imobilização de um membro, forçando uma redução drástica nas atividades e treinamentos. A imobilização de membros é prejudicial para a estrutura do tendão, para a massa muscular, e a função do tendão e o músculo do membro lesionado e frequentemente resulta em um declínio geral nos níveis de atividade. Perda muscular mensurável tem sido relatada em tão pouco tempo quanto 5 dias de imobilização de um membro (Wall et al., 2014) e a alteração da expressão genética foi notada em apenas 48 horas do desuso do músculo (Reich et al., 2010). Deste modo, qualquer lesão que necessite até mesmo de pouca imobilização e/ou baixo desuso muscular pode ter consequências metabólicas e funcionais nocivas.
O mecanismo metabólico para as alterações na massa muscular é o balanço proteico concreto da musculatura (BALC), como exemplo, o balanço entre a taxa da síntese de proteína muscular (SPM) e a quebra de proteína muscular (QPM). Existe perda de massa muscular em qualquer período de tempo quando os intervalos do BALC negativo são maiores que intervalos com BALC positivo. A predominância das evidências sugere que alterações na SPM influenciam mais na perda de massa muscular do que alterações na QPM. Está claro que durante o desuso muscular, a taxa basal da SPM (em repouso ou jejum) está reduzida (Ferrando et al., 1996; Glover et al., 2008), mas a influência da QPM no BALC durante o desuso muscular está menos clara. Medidas da QPM em seres humanos são difíceis de serem realizadas e medidas indiretas são frequentemente necessárias na tentativa de avaliar as alterações na QPM que podem contribuir com a perda muscular. Após 14 dias de repouso acamado severo, medidas dinâmicas da QPM utilizando marcadores isotópicos estáveis mostram que a QPM é reduzida, apesar de uma menor extensão em relação à SPM (Ferrando et al., 1996). Assim, após 14 dias a redução na SPM é maior que a redução na QPM levando a um BALC negativo e perda de massa muscular. Há atualmente evidências preliminares e indiretas – baseadas na expressão do RNAm de proteínas envolvidas nas vias da QPM – de que a QPM pode estar aumentada durante os primeiros dias de imobilização (Wall et al., 2014). Estes dados sugerem que um aumento transitório na QPM pode contribuir com perda de massa muscular logo após a imobilização de um membro. No entanto, aumentos nestes marcadores estáticos e indiretos da QPM não persistem por longos períodos, exemplo 14 dias (Abadi et al., 2009; Glover et al., 2010). Além disso, há evidências convincentes de que marcadores estáveis e indiretos da QPM não representem o metabolismo dinâmico da musculatura (Abadi et al., 2009; Glover et al., 2010; Phillips, 2014). Assim, conclusões consistentes em relação à importância da QPM para a perda de massa muscular durante a imobilização de um membro são insuficientes. Contudo, parece claro que a SPM é o maior mecanismo metabólico por trás do BALC negativo e atrofia muscular por desuso.
Provavelmente a contribuição metabólica mais importante para a perda de massa muscular pelo desuso é a resistência muscular à estimulação anabólica. A resposta da SPM aos aminoácidos e aos exercícios é reduzida após um período de desuso e é denominada “resistência anabólica”. Está claro que a SPM não responde tão bem à ingestão de proteínas após o desuso em comparação com quando a musculatura está ativa (Glover et al., 2008). Além disso, evidências recentes sugerem que simplesmente reduzir a atividade por 14 dias leva à resistência anabólica na musculatura (Breen et al., 2013). Deste modo, mesmo se uma lesão não resultar em imobilidade total de um membro, a atividade reduzida como resultado da lesão poderia levar a danos metabólicos e perda do tamanho e função do músculo. Intervenções nutricionais com foco em combater a redução na SPM basal, assim como combater a resistência anabólica da musculatura, deveriam ser consideradas durante períodos de atividade reduzida e/ou imobilização após uma lesão.
A perda muscular não é a única consequência negativa da inatividade do tecido muscular. A função oxidativa mitocondrial muscular e a flexibilidade metabólica também são prejudicadas com o desuso da musculatura. Quase todos os aspectos da função mitocondrial são impactados (Abadi et al., 2009). Além disso, simplesmente reduzir a atividade do músculo por 14 dias pode levar à sensibilidade à insulina reduzida da musculatura (Breen et al., 2013). Estas alterações adversas na função oxidativa e metabólica do músculo durante a imobilização são mais evidência do potencial impacto prejudicial da redução da atividade muscular ou da imobilização após lesões induzidas por exercícios.
SUPORTE NUTRICIONAL APÓS LESÕES QUE NECESSITAM DE IMOBILIZAÇÃO
Muitas estratégias nutricionais e de nutrientes têm sido propostas para ajudar na melhora da recuperação de lesões induzidas por exercícios envolvendo a imobilização e/ou nível reduzido de atividade. Uma razão para a utilização de muitos destes nutrientes foi proposta, mas pouca informação direta está disponível (Tipton, 2015). Uma avaliação completa de todos os nutrientes mencionados neste contexto está além do escopo deste artigo e deste modo o foco será na ingestão de energia e de proteínas/aminoácidos.
INGESTÃO ENERGÉTICA
A ingestão energética adequada durante a imobilização é fundamental para a máxima recuperação e retorno aos treinamentos. O gasto energético certamente irá diminuir como resultado das atividades e dos treinos reduzidos, enquanto a imobilização de um membro envolvido na deambulação pode necessitar de um declínio ainda maior. Contudo, a redução no gasto energético pode não ser tão grande quanto esperado e uma consideração cuidadosa da ingestão energética deve ser feita antes da realização de recomendações aos atletas lesionados.
Há diversos fatores relativamente sutis, e frequentemente subvalorizados, que podem influenciar o gasto energético e assim determinar a ingestão energética durante a imobilização de membros e na atividade reduzida. A lesão, isoladamente, aumenta o gasto de energia. A magnitude deste aumento, de 15-50%, e a duração do aumento depende inteiramente do tipo e severidade da lesão (Tipton, 2015). Além disso, a deambulação com muletas gasta 2-3 vezes mais em comparação com o gasto de energia ao andar (Waters et al., 1987). Portanto, o gasto energético total pode não diminuir tanto quanto previsto inicialmente, particularmente se o atleta não restringir voluntariamente os movimentos durante a recuperação.
Um esforço para se obter um balanço energético durante a recuperação de uma lesão é essencial. Se a restrição na ingestão energética for muito severa, a recuperação quase que certamente será mais lenta devido à SPM reduzida, prejudicando a regeneração da lesão (Tipton, 2015) e exacerbando a perda de massa muscular (Mettler et al., 2010). Desta forma, deve -se ter cuidado para garantir que energia suficiente seja consumida durante a recuperação de uma lesão. Por outro lado, um balanço energético positivo muito grande também não é desejado para a máxima regeneração e recuperação. Há evidências de que um balanço energético positivo, na verdade acelere a perda muscular durante a inatividade, mais provavelmente através da ativação de inflamações sistêmicas (Biolo et al., 2008). Portanto, uma avaliação cuidadosa do balanço energético tanto durante o período de inatividade quanto de reabilitação pode valer a pena. O balanço energético deveria ser o foco durante a atividade reduzida e/ou imobilização devido a lesões. Ajustes na ingestão energética para corresponder ao gasto de energia à medida que a recuperação avança e a situação metabólica e os padrões de atividade mudam é uma consideração importante.
PROTEÍNAS/AMINOÁCIDOS
As proteínas são claramente o macronutriente associado em maior frequência com o suporte em lesões envolvendo a imobilização e a perda de massa muscular (Tipton, 2015). A ingestão inadequada de proteínas irá prejudicar a regeneração da lesão e exacerbar a perda muscular. Já que a perda de massa muscular resulta do decréscimo da síntese de proteínas miofibrilares (contráteis) (Glover et al., 2018), e que os processos de recuperação dependem altamente da síntese de colágeno e outras proteínas, a importância das proteínas deveria ser óbvia. No entanto, a quantidade ideal de proteínas em qualquer situação de lesão ainda precisa ser determinada.
A quantidade absoluta de proteína a ser consumida diariamente é uma consideração importante para o suporte nutricional nas lesões. A redução da ingestão de proteínas, isoladamente, pode ter um impacto nocivo no metabolismo muscular. Esta interferência pode ser particularmente evidente se a ingestão habitual de proteínas é relativamente alta (≥1,5g de proteínas/kg de massa corporal (MC)/dia). Uma redução repentina na ingestão de proteínas resulta no balanço nitrogenado negativo (Quevedo et al., 1994) e a perda de nitrogênio é quase que certamente proveniente da musculatura durante períodos de balanço energético negativo (Pasiakos et al., 2010). Foi demonstrado que atletas consumindo relativamente altas quantidades de proteína (~2,3g de proteínas/kg MC/dia) tiveram perda muscular reduzida durante períodos de balanço energético negativo em comparação com atletas com menor ingestão de proteínas (~1,0g de proteínas/kg MC/dia) (Mettler et al., 2010). No entanto, não está claro se a perda muscular reduzida foi devido à ingestão de proteínas acima da habitual (1,5 🡺2,3 g de proteínas/kg MC/dia). Ao contrário, a perda muscular no grupo de baixa ingestão proteica poderia ter sido devido ao balanço nitrogenado negativo quando a ingestão de proteínas é menor que a habitual (1,5 🡺 1,0 g de proteínas/kg MC/dia) (Quevedo et al., 1994). Em conjunto, parece evidente que a ingestão de proteínas não deveria ser reduzida repentinamente mesmo em face de uma ingestão energética reduzida e que deveriam acontecer avaliações de rotina apropriadas da ingestão proteica habitual que ajudem com informações para a realização das recomendações de ingestão de proteínas após lesões.
Existem outros fatores a serem considerados, que não a quantidade total de proteínas, para o suporte ideal em relação à perda de massa muscular induzida por lesões. A SPM é maximizada com a ingestão de ~20-25g (Witard et al., 2014) ou ~0,25-0,30g/kg MC (Moore et al., 2014) em uma dose única de proteínas, tanto na musculatura em repouso quanto contraída. No entanto, considerando o início da resistência anabólica com a imobilização e nível reduzido de atividade (Glover et al., 2008), é mais provável que a quantidade de proteínas em cada dose necessária para estimular a SPM ao máximo na musculatura imobilizada seja aumentada. Assim, outro fator importante para o suporte nutricional durante a recuperação de lesões deveria ser uma consideração cuidadosa em relação à quantidade de proteínas em cada refeição.
O conteúdo de aminoácidos essenciais (AAE) da proteína provavelmente é o fator mais importante para a máxima estimulação da SPM (Tipton et al., 1999). Deste modo, a suplementação com AAE tem sido sugerida como uma medida para combater a perda de massa muscular gerada pela inatividade e tem sido mostrada sendo efetiva na melhora da perda muscular nesta situação (Paddon-Jones et al., 2004). Além disso, ao contrário de muitas outras intervenções propostas, a avaliação direta da redução da perda de massa muscular com a suplementação com AAE após lesões tem acontecido (Dreyer et al., 2013). Desta maneira, há evidências da eficácia da suplementação com AAE durante a imobilização, mas certamente não está claro se a suplementação com AAE é mais efetiva que o consumo da proteína inteira contendo a mesma quantidade de AAE. Devido ao custo (e sabor) dos suplementos de AAE, a proteína inteira pode ser uma escolha melhor para a maioria dos atletas lesionados.
Há também evidências de que a leucina, aminoácido de cadeia ramificada, pode ser um AAE particularmente importante na melhora da perda de massa muscular na atividade reduzida, assim como pode ser efetiva na superação da resistência anabólica muscular (Katsanos et al., 2006). Contudo, nenhum estudo investigou diretamente a resposta do músculo em relação à ingestão de leucina durante um período de desuso da musculatura após uma lesão em seres humanos. Além disso, existem potenciais efeitos negativos, por exemplo, a alta concentração de amônia sanguínea e possíveis danos no controle da glicose e neurotransmissores cerebrais com a utilização de suplementação de altas doses de leucina e assim a dose ideal para a suplementação de leucina é desconhecida. Sendo assim, é necessário se ter cautela antes da realização de recomendações com suplementação de leucina durante o desuso da musculatura.
EVIDÊNCIAS DA EFICÁCIA DE OUTROS NUTRIENTES DURANTE A ATROFIA POR DESUSO
Há um fundamento teórico para a eficácia do maior consumo de uma variedade de nutrientes além das proteínas e dos aminoácidos durante a imobilização ou nível reduzido de atividade após lesões. Estes nutrientes incluem a creatina, o n-3FA e antioxidantes. A suplementação com creatina foi mostrada reduzindo a atrofia muscular na imobilização dos braços (Johnston et al., 2009), mas não das pernas (Backx et al., 2017; Hespel et al., 2001). Já que a suplementação com creatina é amplamente utilizada para melhora do ganho muscular durante treinos com exercícios de força (Hespel & Derave, 2007), não deveria ser uma surpresa que a suplementação com creatina aumentasse o ganho muscular depois de 10 semanas de reabilitação após perda de massa muscular induzida pela imobilização (Hespel et al., 2001). No entanto, a creatina não melhorou um novo ganho muscular com um período de recuperação mais curto de atrofia muscular induzida pelo desuso (Backx et al., 2017). Assim, parece que as recomendações para a utilização da creatina por atletas lesionados pode ser circustanciais, já que a eficácia é clara durante períodos mais longos de hipertrofia muscular, mas não em períodos mais curtos, enquanto o impacto na melhora da perda muscular é incerto.
Um respaldo considerável para a utilização de n-3FA como suporte nutricional em lesões está disponível. Em muitos casos, este interesse está relacionado com as propriedades anti-inflamatórias e imunomoduladoras do n-3FA (Calder, 2013). Além disso, há evidências preliminares sugerindo que a suplementação com óleo de peixe poderia ter um papel na melhora da perda de massa muscular por desuso (You et al., 2010; Smith et al., 2011). Atualmente, não existem dados mostrando que a suplementação com n-3FA efetivamente restrinja a perda muscular em seres humanos. E ainda, a dose adequada para indivíduos lesionados não foi estabelecida. Desta maneira, recomendações generalizadas para a suplementação com óleo de peixe durante a imobilização devem ser consideradas prematuras e é necessário se ter cautela.
O dano oxidativo é frequentemente uma preocupação imediatamente após uma lesão. O dano oxidativo é tido como um fator contribuinte para a perda de massa muscular, principalmente pelo aumento da QPM (Magne et al., 2013). Deste modo, compostos antioxidantes incluindo o n-3FA têm sido comumente recomendados para melhorar a regeneração e a recuperação (Demling, 2009; Magne et al., 2013). Em altas doses, a suplementação com antioxidantes parece ter um impacto na perda muscular em roedores (Magne et al., 2013). No entanto, doses equivalentes iriam provavelmente ser problemáticas e possivelmente tóxicas se ingeridas por seres humanos (Magne et al., 2013). Doses mais baixas que podem ser melhor toleradas não tendem a ser tão efetivas. Em um estudo com seres humanos, a suplementação com vitamina C e E falhou em influenciar a recuperação da disfunção muscular após cirurgia de joelho (Barker et al., 2009). No entanto, o nível de vitamina C anteriormente a suplementação foi correlacionado com melhoras na função muscular. Assim, em conjunto estes resultados sugerem que a ingestão suficiente de antioxidantes é importante para a máxima recuperação, mas a suplementação além da suficiência é desnecessária se o nível do nutriente em questão está adequado.
SUPORTE NUTRICIONAL EM OUTRAS LESÕES
Nem todas as lesões necessitam de imobilização de membros, e mesmo quando os treinamentos são restringidos ou reduzidos, a perda de massa muscular pode ser menor e as consequências metabólicas podem não ser tão severas. Além disso, há evidências de que algumas lesões podem ter necessidades nutricionais específicas. Infelizmente, até o momento muito pouco é conhecido sobre as respostas em relação à nutrição em indivíduos lesionados e/ou os dados disponíveis são incertos. No entanto, uma breve discussão sobre o que pouco se sabe referente à nutrição como auxílio em alguns tipos específicos de lesão parece ser necessária. Mencionar estas questões é importante para estimular certa cautela antes da adoção de uma estratégia nutricional divulgada por muitos dos “de certa forma denominados” especialistas.
CONCUSSÃO (LESÃO CEREBRAL TRAUMÁTICA)
Lesões cerebrais traumáticas (LCT) em atletas estão atraindo cada vez mais atenção e investigações. Em esportes de contato, como o rugby e o futebol americano, estas lesões são cada vez mais comuns. No entanto, ainda não há terapias aprovadas para tratar as LCT e os processos inerentes e para melhorar a recuperação neste tipo de lesão (Barrett et al., 2014). Desta maneira, parece claro que uma intervenção nutricional que poderia melhorar as consequências das LCT e melhorar a função cognitiva e neuromuscular pode ser inestimável para atletas ativos e aposentados.
Agentes antioxidantes e anti-inflamatórios são o foco de quase todas as pesquisas relacionadas à nutrição para as LCT. As pesquisas até o momento são baseadas quase que inteiramente em modelos com camundongos. Estudos animais consistentemente demonstram que tanto a utilização profilática quanto terapêutica do n-3FA e da curcumina aumentam a função cognitiva, assim como indícios mecânicos do dano neural (Barrett et al., 2014). Na atual conjuntura, muito poucos dados foram publicados examinando esta questão em seres humanos. Há um pequeno número de estudos de caso sugerindo que altas doses do n-3FA podem melhorar os efeitos agudos após as LCT. Recentemente, há resultados promissores para a eficácia da suplementação com o ácido docosahexaenóico (DHA), um dos componentes do n-3FA, para a redução de marcadores do trauma de cabeça em jogadores de futebol americano (Oliver et al., 2016). Contudo, não há um consenso sobre o melhor biomarcador para as LCT, então os resultados de apenas um estudo deve ser visto com cautela. Curiosamente, este estudo sugere que uma grande quantidade de uma boa coisa pode não ser tão positiva. Doses maiores de DHA resultaram em resultados mais pobres. Assim, não apenas há incertezas sobre a atual eficácia, devido à escolha do biomarcador, mas a dose ideal precisa ser determinada. Deste modo, não está claro se a eficácia do n-3FA para as LCT em camundongos pode ser aplicada apropriadamente aos seres humanos. Portanto, enquanto dados pré-clínicos e preliminares sobre o impacto do n-3FA para a recuperação das LCT são promissores, recomendações consistentes para incluir o n-3FA em um regime de tratamento não podem ser realizadas, pelo menos não até que os resultados dos ensaios clínicos em andamentos sejam relatados.
LESÕES NO TECIDO MUSCULAR
Lesões comuns induzidas pelos exercícios incluem aquelas com a danificação da musculatura e outros tecidos moles. Um modelo comum utilizado para examinar lesões musculares é o modelo do exercício excêntrico (alongamento muscular enquanto contraído), que resulta em dor muscular e perda da função muscular (Sousa et al., 2014). Enquanto os nutrientes têm sido sugeridos como medidas para combater as lesões musculares, estudos sugerindo que as proteínas e/ou aminoácidos livres podem aliviar alguns indicadores de danos musculares são mais proeminentes. Outros estudos não relatam um efeito das proteínas ou dos aminoácidos. Os resultados divergentes provavelmente são devido aos padrões variáveis de suplementação, tipos de exercício e outras considerações em relação ao desenho dos estudos (Sousa et al., 2014). A oferta de agentes antioxidantes e anti-inflamatórios para aliviar os sintomas do dano muscular tem sido sugerida como outra estratégia popular. No entanto, na melhor das hipóteses, assim como com as proteínas, a literatura pode apenas ser considerada incerta. Apesar desta natureza inconsistente dos estudos investigando a eficácia das proteínas, antioxidantes e outros nutrientes, muitas recomendações são realizadas comumente (Sousa et al., 2014). Claramente, dado a disparidade nos tipos de exercício, padrões de suplementação e outras questões metodológicas, muito poucos insights em relação à nutrição para as lesões musculares podem ser adquiridas dos estudos sobre o dano muscular induzido pelos exercícios. Consequentemente, não é possível fazer recomendações consistentes referentes às medidas nutricionais para combater lesões e danos musculares induzidos pelos exercícios. O leitor é aconselhado a ter cautela antes de tentar qualquer método nutricional em particular em atletas com lesões musculares.
O QUE DEVE SER EVITADO
O principal foco da discussão acima foi quais nutrientes deveriam ser consumidos. Contudo, deve-se considerar também quais os nutrientes a serem evitados. Como mencionado acima, a consideração nutricional mais clara é evitar deficiências nutricionais. Por outro lado, o excesso de nutrientes também deve ser evitado.
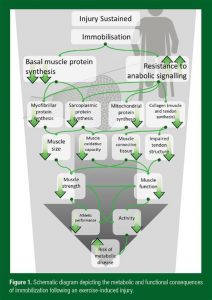
Figura 1. Diagrama apresentando as consequências metabólicas e funcionais da imobilização após uma lesão induzida por exercícios.
Tradução da figura:
Lesão contínua/Imobilização
Síntese basal de proteína muscular/Resistência à sinalização anabólica
Síntese de proteína miofibrilar/Síntese de proteína sarcoplasmática/Síntese de proteína mitocondrial/Colágeno (síntese muscular e de tendão)
Tamanho do músculo/Capacidade oxidativa do músculo/Tecido muscular conectivo/Estrutura do tendão prejudicada
Força muscular/Função muscular
Performance atlética/atividade
Risco de doenças metabólica
Enquanto muitos podem considerar este um fato óbvio, evitar a ingestão excessiva de álcool é importante após uma lesão. A ingestão de álcool prejudica a síntese de proteína muscular (Vargas & Lang, 2008) e a regeneração da lesão, provavelmente por reduzir as respostas inflamatórias (Jung et al., 2011). Desta forma, pelo menos em ratos, a ingestão de álcool aumenta a perda de massa muscular durante a imobilização (Vargas & Lang, 2008). Mesmo sendo evidente, vale enfatizar que a ingestão limitada de álcool durante a recuperação é importante. Assim, por mais tentador que a ingestão de álcool para melhorar a situação ou diminuir a dor possa ser, apenas uma pequena quantidade, caso exista, deveria ser ingerida.
RESUMO E APLICAÇÕES PRÁTICAS
Para resumir, ainda tem muito a ser aprendido sobre as melhores estratégias nutricionais na melhora da recuperação de lesões induzidas pelos exercícios. Há alegações para a eficácia de muitos nutrientes, ainda que infelizmente faltem evidências diretas. Está claro que uma avaliação cuidadosa da situação de cada paciente deve ser conduzida antes da realização de quaisquer recomendações nutricionais como suporte à recuperação de lesões induzidas pelos exercícios.
- A melhor recomendação seria adotar uma abordagem “primeiro, não prejudique”. A utilização e quantidade de cada nutriente deve ser considerada em um contexto da relação de risco-benefício individualmente para cada atleta que esteja enfrentando uma situação específica de lesão. Mesmo que os benefícios sejam incertos, pode valer a pena tentar, caso não se identifique riscos.
- Como sempre, o fundamento de uma estratégia nutricional para um praticante de atividade física lesionado deveria ser uma dieta balanceada baseada em alimentos frescos (ou refeições feitas a partir destes alimentos), que são minimamente processados.
- Deficiências, particularmente de energia, proteínas e micronutrientes, devem ser evitadas. O balanço energético é crucial.
- O estado nutricional e as necessidades de energia deveriam ser avaliados ao longo da recuperação e a ingestão de nutrientes ajustada de acordo.
- Uma maior ingestão de proteínas (~2-2,5g de proteínas/kg MC/dia) pode ser necessária. Ao menos, a quantidade absoluta da ingestão de proteínas deveria ser mantida mesmo no caso de uma ingestão reduzida de energia.
- Há evidências promissoras para a eficácia de outros nutrientes, por exemplo, a leucina, a curcumina e o n-3FA, em certas situações, mas elas devem ser consideradas preliminares. É necessário se ter cautela antes da realização de recomendações para a utilização generalizada destes nutrientes por atletas lesionados.
- Atualmente, as recomendações consistentes para intervenções nutricionais como medida para tratar lesões cerebrais traumáticas e lesões musculares são prematuras. O mesmo bom senso em relação às recomendações nutricionais se aplica à estas lesões, assim como as citadas acima.
REFERÊNCIAS
Abadi, A., E.I. Glover, R.J. Isfort, S. Raha, A. Safdar, N. Yasuda, J.J. Kaczor, S. Melov, A. Hubbard, X. Qu, S.M. Phillips, and M. Tarnopolsky (2009). Limb immobilization induces a coordinate down-regulation of mitochondrial and other metabolic pathways in men and women. PLoS One 4:e6518.
Backx EM, R. Hangelbroek, T. Snijders, M.L. Verscheijden, L.B. Verdijk, L.C. de Groot, and L.J. van Loon LJ (2017). Creatine loading does not preserve muscle mass or strength during leg immobilization in healthy, young males: a randomized controlled trial. Sports Med. E-pub ahead of print (PMID 28054322).
Barker, T., S.W. Leonard, J. Hansen, R.H. Trawick, R. Ingram, G. Burdett, K.M. Lebold, J.A. Walker, and M.G. Traber (2009). Vitamin E and C supplementation does not ameliorate muscle dysfunction after anterior cruciate ligament surgery. Free Rad. Biol. Med. 47:1611-1618.
Barrett, E.C., M.I. McBurney, and E.D. Ciappio (2014). Omega-3 fatty acid supplementation as a potential therapeutic aid for the recovery from mild traumatic brain injury/concussion. Adv. Nutr. 5:268-277.
Biolo, G., F. Agostini, B. Simunic, M. Sturma, L. Torelli, J.C. Preiser, G. Deby-Dupont, P. Magni, F. Strollo, P. di Prampero, G. Guarnieri, I.B. Mekjavic, R. Pisot, and M.V. Narici (2008). Positive energy balance is associated with accelerated muscle atrophy and increased erythrocyte glutathione turnover during 5 wk of bed rest. Am. J. Clin. Nutr. 88:950-958.
Breen, L., K.A. Stokes, T.A. Churchward-Venne, D.R. Moore, S.K. Baker, K. Smith, P.J. Atherton, and S.M. Phillips (2013). Two weeks of reduced activity decreases leg lean mass and induces “anabolic resistance” of myofibrillar protein synthesis in healthy elderly. J. Clin. Endocrinol. Metab. 98:2604-2612.
Calder, P.C (2013). n-3 fatty acids, inflammation and immunity: new mechanisms to explain old actions. Proc. Nutr. Soc. 72:326-336.
Demling, R.H (2009). Nutrition, anabolism, and the wound healing process: an overview. Eplasty 9:e9.
Dreyer, H.C., L.A. Strycker, H.A. Senesac, A.D. Hocker, K. Smolkowski, S.N. Shah, and B.A. Jewett (2013). Essential amino acid supplementation in patients following total knee arthroplasty. J. Clin. Invest. 123:4654-4666.
Ferrando, A.A., H.W. Lane, C. A. Stuart, J. Davis-Street, and R.R. Wolfe (1996). Prolonged bed rest decreases skeletal muscle and whole body protein synthesis. Am. J. Physiol. 270:E627-633.
Glover, E.I., S.M. Phillips, B.R. Oates, J.E. Tang, M.A. Tarnopolsky, A. Selby, K. Smith, and M.J. Rennie (2008). Immobilization induces anabolic resistance in human myofibrillar protein synthesis with low and high dose amino acid infusion. J. Physiol. 586:6049-6061.
Glover, E.I., N. Yasuda, M.A. Tarnopolsky, A. Abadi, and S.M. Phillips (2010). Little change in markers of protein breakdown and oxidative stress in humans in immobilization-induced skeletal muscle atrophy. Appl. Physiol. Nutr. Metab. 35:125-133.
Hespel, P., and W. Derave (2007). Ergogenic effects of creatine in sports and rehabilitation. Subcell. Biochem. 46:245-259.
Hespel, P., B. Op’t Eijnde, M. Van Leemputte, B. Urso, P.L. Greenhaff, V. Labarque, S. Dymarkowski, P. Van Hecke, and E.A. Richter (2001). Oral creatine supplementation facilitates the rehabilitation of disuse atrophy and alters the expression of muscle myogenic factors in humans. J. Physiol. 536:625-633.
Johnston, A.P., D.G. Burke, L.G. MacNeil, and D.G. Candow (2009). Effect of creatine supplementation during cast-induced immobilization on the preservation of muscle mass, strength, and endurance. J. Strength Cond. Res. 23:116-120.
Jung, M.K., J.J. Callaci, K.L. Lauing, J.S. Otis, K.A. Radek, M.K. Jones, and E.J. Kovacs (2011). Alcohol exposure and mechanisms of tissue injury and repair. Alcohol Clin. Exp. Res. 35:392-399.
Katsanos, C.S., H. Kobayashi, M. Sheffield-Moore, A. Aarsland, and R.R. Wolfe (2006). A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. Am. J. Physiol. 291:E381-387.
Magne, H., I. Savary-Auzeloux, D. Remond, and D. Dardevet (2013). Nutritional strategies to counteract muscle atrophy caused by disuse and to improve recovery. Nutr. Res. Rev. 26:149-165.
Mettler, S., N. Mitchelland K.D. Tipton (2010). Increased protein intake reduces lean body mass loss during weight loss in athletes. Med. Sci. Sports Exerc. 42:326-337.
Moore, D.R., T.A. Churchward-Venne, O. Witard, L. Breen, N.A. Burd, K.D. Tipton, and S.M. Phillips (2014). Protein ingestion to stimulate myofibrillar protein synthesis requires greater relative protein intakes in healthy older versus younger men. J. Gerontol. A Biol. Sci. Med. Sci. 70:57-62.
Oliver, J.M., M.T. Jones, K.M. Kirk, D.A. Gable, J.T. Repshas, T.A. Johnson, U. Andréasson, N. Norgren, Z. Blennow, and H. Zetterberg. (2016) Effect of docosahexaenoic acid on a biomarker of head trauma in American football. Med. Sci. Sport Exer. 48:974-982.
Paddon-Jones, D., M. Sheffield-Moore, R.J. Urban, A.P. Sanford, A. Aarsland, R.R. Wolfe, and A.A. Ferrando (2004). Essential amino acid and carbohydrate supplementation ameliorates muscle protein loss in humans during 28 days bedrest. J. Clin. Endocrinol. Metab. 89:4351-4358.
Pasiakos, S.M., L.M. Vislocky, J.W. Carbone, N. Altieri, K. Konopelski, H.C. Freake, J.M. Anderson, A.A. Ferrando, R.R. Wolfe, and N.R. Rodriguez (2010). Acute energy deprivation affects skeletal muscle protein synthesis and associated intracellular signaling proteins in physically active adults. J. Nutr. 140:745-751.
Phillips, S.M (2014). A brief review of critical processes in exercise-induced muscular hypertrophy. Sports Med. 44:S71-S77.
Quevedo, M.R., G.M. Price, D. Halliday, P.J. Pacy, and D.J. Millward (1994). Nitrogen homoeostasis in man: diurnal changes in nitrogen excretion, leucine oxidation and whole body leucine kinetics during a reduction from a high to a moderate protein intake. Clin. Sci. 86:185-193.
Reich, K.A., Y.W. Chen, P.D. Thompson, E.P. Hoffman, and P.M. Clarkson (2010). Forty-eight hours of unloading and 24 h of reloading lead to changes in global gene expression patterns related to ubiquitination and oxidative stress in humans. J. Appl. Physiol. 109:1404-1415.
Smith, G.I., P. Atherton, D.N. Reeds, B.S. Mohammed, D. Rankin, M.J. Rennie, and B. Mittendorfer (2011). Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial. Am. J. Clin. Nutr. 93:402-412.
Sousa, M., V.H. Teixeira, and J. Soares (2014). Dietary strategies to recover from exercise-induced muscle damage. Int. J. Food Sci. Nutr. 65:151-163.
Tipton, K.D. (2015). Nutritional support for exercise-induced injuries. Sports Med. 45:S93-S104.
Tipton, K.D., A.A. Ferrando, S.M. Phillips, D. Doyle Jr., and R.R. Wolfe (1999). Postexercise net protein synthesis in human muscle from orally administered amino acids. Am. J. Physiol. 276:E628-634.
Vargas. R., and C.H. Lang (2008). Alcohol accelerates loss of muscle and impairs recovery of muscle mass resulting from disuse atrophy. Alcoholism: Clin. Exp. Res. 32:128-137.
Wall, B.T., M.L. Dirks, T. Snijders, J.M. Senden, J. Dolmans, and L.J. van Loon (2014). Substantial skeletal muscle loss occurs during only 5 days of disuse. Acta Physiol. 210:600-611.
Waters, R.L., J. Campbell, and J. Perry (1987). Energy cost of three-point crutch ambulation in fracture patients. J. Orthop. Trauma 1:170-173.
Witard, O.C., S.R. Jackman, L. Breen, K. Smith, A. Selby, and K.D. Tipton (2014). Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise. Am. J. Clin. Nutr. 99:86-95.
You, J.-S., M.-N. Park, W. Song, and Y.-S. Lee (2010). Dietary fish oil alleviates soleus atrophy during immobilization in association with Akt signaling to p70s6k and E3 ubiquitin ligases in rats. Appl. Physiol. Nutr. Metab. 35:310-318.






